- introduktion
- material och metoder
- instrumentanalys
- mikrobiella kulturer
- Mediapreparat
- jäsning av Drostanolone Enanthate (1) med C. aphidicola ATCC 28300 och F. lini NRRL 2204
- 2 kg-metyl-3 kg, 14 kg,17 kg-trihydroxi-5 kg-androstan (2)
- 2α-Metyl-7α-hydroxi-5α-androstan-3,17-dion (3)
- 2α-Metyl-3α,17β-dihydroxi-5α-androstane (4)
- 2-Methylandrosta-1,4-dien-3,17-dion (5)
- 2-Methylandrosta-11 kg-hydroxi-1,4-dien-3,17-dion (6)
- 2-Methylandrosta-14 kg-hydroxi-1,4-dien-3,17-dion (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- resultat och diskussion
- strukturförklaring
- cytotoxicitet mot HeLa, PC3, H640 och HCT116 Cancer och 3T3 normala cellinjer
- struktur-Aktivitetsförhållande
- slutsats
- Författarbidrag
- intressekonflikt uttalande
- bekräftelser
- kompletterande Material
introduktion
mikrobiell transformation är en av de viktigaste metoderna för strukturell transformation av olika klasser av organiska föreningar. Denna teknik har framgångsrikt använts inom grön kemi, dvs. läkemedelsupptäckts-och utvecklingsprogrammen, som ger en utmärkt källa till föreningar runt kärnstrukturer, följt av screening för olika biologiska aktiviteter. I flera fall har mikrobiell transformation använts som ett viktigt verktyg för regio-, kemo-och stereoselektiva omvandlingar av organiska föreningar som är svåra att uppnå med konventionella metoder (Holland och Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). På grund av den inaktiva naturen hos kolväteskelett av steroider är de ofta svåra att derivatiseras med konventionella syntetiska metoder. Därför används mikrobiell transformation ofta för strukturell förändring av steroider. Närvaron av P450 cytokromenzymsystem i svampar gör helcellsbiokatalys till ett effektivt verktyg för stereo-och regio-specifik hydroxylering (Choudhary et al., 2005a; Tong och Dong, 2009; Kristan och Ri Brasiliner, 2012; Baydoun et al., 2014).
Drostanolone och dess esterderivat, såsom drostanolonpropionat, drostanolonpentanoat och drostanolonenantat (1) är anabola androgena steroider (Aass) som används av idrottare för att stärka sina muskler utan att få fett. Dessutom har Drostanolon och dess esterderivat förmågan att hämma produktionen av östrogen. Propionatester av drostanolone används också för behandling av bröstcancer, under varumärket Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al., 2002; Bahrke och Yesalis, 2004).
Cancer är för närvarande erkänd som en stor folkhälsoutmaning. Cancers är den näst ledande dödsorsaken i USA och över hela världen. Enligt Världshälsoorganisationen (WHO) överstiger förekomsten av cancer 6 miljoner fall per år. Cancerceller har hög proliferationshastighet. De sprider sig snabbt i det levande systemet och kan överleva mot starka kemoterapeutika och DNA-skadliga medel. På liknande sätt har cytotoxiska läkemedel många negativa effekter på normala celler, och därmed är deras användning vid cancerkemoterapi en terapeutisk utmaning. På grund av detta behövs utveckling av säkra, effektiva och selektiva kemoterapeutiska medel mot olika cancerformer (Munoz-Pinedo et al., 2012; Su et al., 2015; Swadogo et al., 2015; Rebecca et al., 2016).
bröstcancer är en av de vanligaste cancerformerna i 140 länder i världen. Det är en viktig orsak till cancerrelaterad död hos kvinnor över hela världen, kännetecknad av onormal tillväxt av celler i bröstloberna eller kanalerna med hög proliferationshastighet (Hanahan och Weinberg, 2000; Ferlay et al., 2015).
livmoderhalscancer är den näst mest dominerande cancer hos kvinnor över hela världen, efter bröstcancer. Den främsta orsaken till livmoderhalscancer är bildandet av maligna celler i livmoderhalsens vävnader (Wang et al., 2013; Hafiza och Latifah, 2014; Pariente et al., 2016). HeLa cancercellinjen, erhållen från humana livmoderhalscancerceller, är en vanlig cellulär modell för att utvärdera den cytotoxiska potentialen hos testföreningar.
prostatacancer är den näst ledande cancer i manliga världen efter bronkus cancer, och den tredje vanligaste orsaken till cancer död. Det är den vanligaste orsaken till malignitet hos män. Dess förekomst ökar med ålder, vanligare över 50 år (Henry och omahony, 1999; de-Bono et al., 2010; Wenbin et al., 2015). PC – 3-cancercellinjen, erhållen från manliga prostatacancerceller, är en allmänt använd modell för att undersöka toxiciteten hos testföreningar.lungcancer är en mycket vanlig cancer bland män i USA sedan mitten av 1950-talet och bland kvinnor sedan slutet av 1980-talet. Det är en ledande orsak till cancerrelaterad död. Lungcancer tillskrivs mest rökning (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). H460-cancercellinjen, erhållen från humana lungcancerceller (lymfogen metastatisk sublinje av humant storcellslungkarcinom), används ofta för att utvärdera cytotoxicitet hos testföreningar.
efter bröst -, lung-och prostatacancer är koloncancer den fjärde vanligaste cancer över hela världen. Det är cancer som finns i ungefär lika stor frekvens hos män och kvinnor. Det är den näst vanligaste orsaken till cancerrelaterade dödsfall i västländer (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). Hct116-cancercellinjen, erhållen från humana koloncancerceller, används vanligtvis för att bedöma cytotoxiciteten hos testföreningar.
i fortsättningen av våra studier om svamptransformation av bioaktiva steroider (Choudhary et al., 2005B, c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017) syntetiserade vi analoger av drostanolone enanthate (1) genom dess omvandling med Cephalosporium aphidicola och Fusarium lini. Metaboliter 2-9, såväl som substrat 1, utvärderades mot HeLa (cervical carcinoma), PC-3 (prostatacarcinoma), H460 (lungcancer), HCT116 (koloncancer) och 3T3 (mouse fibroblast normal) cellinjer, med användning av cellbaserad analys med hög genomströmning, den mest effektiva och bekväma laboratoriemetoden, MTT-analysen för att förutsäga svaret hos testföreningar i maligniteter där de visade specificitet mot cancercellerna. Denna studie har således identifierat Anti-cancermetaboliter av drostanolone enanthate (1) för ytterligare studier.
material och metoder
instrumentanalys
tunnskiktskromatografi (TLC) (silikagel, 20 20, 0,25 mm tjock, pf254, Merck, Tyskland) användes för analys av graden av transformation och renhet. Kiselgelkolonnkromatografi (70-230 mesh, E. Merck, Tyskland) användes för initial rening av metaboliter. Dessutom användes preparativ omvänd fasåtervinning (JAI LC-908w, Japan), utrustad med YMC L-80 (4-5 kg, 20-50 mm i.d.) för slutlig rening av metaboliter. Strukturer av metaboliter belystes med hjälp av 1H-(400, 500 och 600 MHz) och 13C-NMR (100, 125 och 150 MHz) spektra, vilka registrerades på Bruker Avance-NMR-spektrometrar (Frankrike) i CD3OD, CD3COCD3 eller DMSO-d6. Hrei-MS-och IR-spektra utfördes på JEOL JMS – 600h (Japan) (dubbelfokuserande magnetisk sektormassanalysator) masspektrometer (EI, elektronpåverkan jonisering) respektive Bruker vektor 22 FT-IR spektrofotometer. Optiska rotationer av metaboliter registrerades på JASCO p-2000 polarimeter (Japan). Evolution 300 UV-synlig spektrofotometer användes för att registrera UV-spektra. Smältpunkterna för de transformerade produkterna mättes med hjälp av Buchi m-560 (Schweiz) instrument. Enkelkristallröntgendiffraktionsdata samlades in på Bruker APEXII D8 Venture diffraktometer, utrustad med foton 100-detektor (CMOS-teknik) och finfokusförseglat rör med röntgenkälla (Cu Ka-strålningar 2,54178 xnumx). Reflektionsintensiteter integrerades med SAINT-programvara. Absorptionskorrigering gjordes på Multi-scan, och strukturen löstes av SHELXTL-programmet (Gerlier och Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
mikrobiella kulturer
mikrobiell kultur av C. aphidicola ATCC 28300 och F. lini NRRL 2204 erhölls från American type Culture Collection (ATCC) respektive Northern Regional Research Laboratories (NRRL). Kulturer odlades på sabouraud dextros agar (SDA) vinkling, och bibehölls vid 4 msk C.
Mediapreparat
fyra liter media för tillväxt av C. aphidicola ATCC-28300 framställdes genom att blanda 200 g glukos, 4 g KH2PO4, 8 g glycin, 4 g KCl, 8 g MgSO4.7H2O, och 8 mL spårämnen i 4 L destillerat vatten. På samma sätt bereddes fyra liter media för F. lini NRRL 2204 genom att blanda 40 g glukos, 20 g jästextrakt, 20 g pepton, 20 g KH2PO4, 20 g NaCl och 40 mL glycerol i 4 liter destillerat vatten.
jäsning av Drostanolone Enanthate (1) med C. aphidicola ATCC 28300 och F. lini NRRL 2204
Medium för tillväxt av C. aphidicola och F. lini bereddes genom att blanda ovan nämnda ingredienser i 4 L destillerat vatten för varje svamp, som sedan dispenserades jämnt i 40 Erlenmeyer-kolvar på 250 mL (100 mL i varje kolv). Alla dessa kolvar autoklaverades vid 121 CB och inokulerades med SDA-lutningar av C. aphidicola ATCC 28300 och F. lini NRRL 2204 under steriliserade betingelser. Dessa svampkulturer innehållande kolvar lämnades på den roterande skakan (121 rpm) vid 26 2 C i 3-4 dagar för att uppnå maximal tillväxt av C. aphidicola och F. lini. Förening 1 (1 g) löstes i 20 mL aceton för varje svamp och dispenserades 0,5 mL i varje kolv och placerades igen på roterande shaker i 12 dagar. En negativ kontroll (medium + svampkultur) såväl som positiv kontroll (medium + substrat) bereddes också analogt för att utvärdera svampmetaboliterna respektive nedbrytningen av förening 1. Efter inkubation av 12 dagar filtrerades alla kolvarna och extraherades med 20 L diklormetan (DCM), organisk fas separerades och indunstades sedan under reducerat tryck på roterande förångare. Detta gav 1,5 g ljusgul fast råolja. Detta råmaterial fraktionerades över kiselgelkolonnkromatografi genom eluering med gradienthexaner och acetonlösningssystem. Kolonnkromatografi gav fyra huvudfraktioner (1-4), som sedan renades genom återvinning av HPLC. Metaboliter 2 (tR = 16 min, 8 mg, 0,8%), 3 (tR = 19 min, 11 mg, 1,1%), 4 (tR = 17 min, 35 mg, 3,5%), 5 (tR = 23 min, 42 mg, 4,2%), 6 (tR = 20 min, 9 mg, 0,9%), 7 (tR = 21 min, 12 mg, 1,2%) och 9 (tR = 18 min, 5 mg, 0,5%) renades från fraktioner 1-7, respektive, genom omvänd fas återvinning HPLC med användning av metanol – vatten som lösningsmedelssystem (meoh: H2o; 70: 30). Medan metabolit 8 erhölls från fraktion 8 genom normal fasåtervinning HPLC (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0, 75%).
2 kg-metyl-3 kg, 14 kg,17 kg-trihydroxi-5 kg-androstan (2)
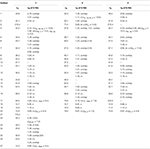
tabell 1. 13C-och 1H-NMR-kemiska skiftdata (J och W1/2 i Hz) för föreningar 1-3 (POV).
2α-Metyl-7α-hydroxi-5α-androstan-3,17-dion (3)
2α-Metyl-3α,17β-dihydroxi-5α-androstane (4)
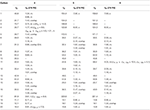
plats för Tabell 2. 13C-och 1H-NMR-kemiska skiftdata (J och W1/2 i Hz) för föreningar 4-6 (POV).
2-Methylandrosta-1,4-dien-3,17-dion (5)
2-Methylandrosta-11 kg-hydroxi-1,4-dien-3,17-dion (6)
2-Methylandrosta-14 kg-hydroxi-1,4-dien-3,17-dion (7)
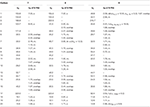
tabell 3. 13C-och 1H-NMR-kemiska skiftdata (J och W1/2 i Hz) för föreningar 7-9 (POV).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Cellinjer odlades i DMEM F12-media, kompletterat med 10% FBS under en 5% CO2-atmosfär vid 37 kcal C i en inkubator.
den kolorimetriska analysen MTT användes för utvärdering av cellmetabolisk aktivitet. I denna analys reduceras den gula MTT till lila formazon i mitokondrierna hos de levande cellerna (Gerlier och Thomasset, 1986). Ju mer levande celler, desto mer färg och därmed mer absorbans observeras av kolorimeter (Fesahat et al., 2015). Vi har använt denna metod för att analysera effekten av våra transformerade produkter på cellulär cytotoxicitet mot cancerceller. Cirka 10 000 celler i varje cellinje (HeLa, PC3, H460, hct116 cancer och 3T3 normal) såddes i 96-brunnsplattor. Efter att ha nått 80-90% konfluens, behandlades de med olika koncentrationer av föreningar (25, 50, 75, 100 och 200 mic) för 24 h. alla föreningar löstes i steril DMSO för att göra en 200 mM stamlösning. Lösningen filtrerades och seriella utspädningar gjordes i tillväxtmedium. 600 UCL av varje utspädning användes för att behandla 3 brunnar (tre exemplar av varje) av 96 brunnsplatta dvs 200 UCL vardera. Varje experiment utfördes i tre biologiska replikat. MTT tillsattes och inkuberades i 4 timmar. efter avlägsnande av MTT löstes de lila formazonkristallerna i DMSO och läsning observerades vid 540 respektive 570 nm för normala respektive cancerceller. Multiskan-läsaren ger sackimax vid 540 nm i DMSO-behandlade 3T3 fibroblastceller (som är mer sammanflytande i morfologi) medan i fall av cancerceller ger 570 nm sackimax (Bonmati-Carrion et al., 2013; Danihelov Bisexual et al., 2013). Ett brett spektrum av epitelkarcinomcellinjer användes i detta experiment där cisplatin var ett vanligt läkemedel av val. Det riktar sig mot DNA, stör celldelning under mitos och inducerar apoptos (Eastman, 1999). IC50-värden beräknades för att bestämma den minsta koncentration som krävs för att döda 50% av cellerna.
medan
At = Absorbansvärde för testförening
Ab = Absorbansvärde för blank
Ac=Absorbansvärde för kontroll
resultat och diskussion
strukturförklaring
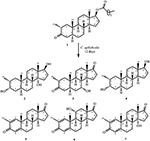
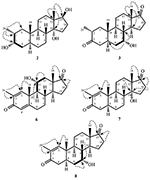
figur 1. Biotransformation av drostanolone enanthate (1) med Cefalosporium aphidicola.
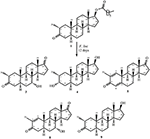
Figur 2. Biotransformation av drostanolone enanthate (1) med Fusarium lini.
metabolit 2 isolerades som vita kristaller. Molekylformeln C20H30O3 baserades på HREI-MS som visade at m/z 322.2517 (calcd. 322.2508, C20H34O3), vilket tyder på tillsats av tre väte och en syreatom, reduktion av C-3 ketonisk karbonyl och hydrolytisk klyvning av heptanoat sidokedja i substrat 1. IR-absorbansen vid 3,531 och 3,423 cm-1 berodde på närvaro av hydroxylgrupper. 1H-NMR-spektrumet visade en ytterligare Metin-protonsignal vid 2,69 (tabell 1) (datablad 2). Signalerna för heptanoat sidokedja hittades också saknas i 1H-NMR spektrum av förening 2. 13C-NMR-spektrumet visade signaler för ett nytt metinkol vid 71,4 och ett nytt kvartärt kol vid 84,8. Kolsignaler för heptanoatkedja och ketonisk karbonyl hittades också saknade i 13C-NMR-spektrumet. Detta föreslog reduktion av C-3-karbonyl, hydrolytisk förlust av heptanoatkedja och tillsats av en OH vid C-14 (Tabell 1). OH-gruppen placerades vid C – 3 på grundval av hmbc-korrelationer av H3-20 (0.91, d) med C-3 (71.4) (Figur 3). Detta berodde på reduktionen av C-3 karbonyl. Andra OH-gruppen placerades vid C-14, baserat på hmbc-korrelationen av H3-18 (0,81, s) med C-14 (84,8). Den tredje OH var vid C-17, härrörde från hydrolytisk förlust av heptanoatdel. O-H-gruppen vid C – 3 härleddes till att vara bisexuell-orienterad baserat på NOESY-korrelationerna av H-3 (3,69, 3,69, br. s) med H-2 (1,64, överlappning) och H3-20 (0,91, d) (Figur 4). OH – 14 härleddes för att vara bisexuell orienterad, baserat på NOESY korrelationer av H-9 (1,32, m) med OH-14 (2,66, s) (aceton-d6). Enkelkristallröntgendiffraktionsanalys stödde ytterligare strukturen hos metabolit 2, bestående av tre ringar i stolskonformation (A, B och C) och en i kuvertkonformation (D). Tre OH-grupper vid C-3, C-14 och C-17 tilldelades, orienteringen av de två grupperna, och orienteringen av de två grupperna (Figur 5). Enkelkristalldiffraktionsdata för metabolit 2 skickades till Cambridge Crystallographic data Collection (CCDC 1500706). Strukturen av metabolit 2 härleddes sålunda som 2 kg-metyl-3 kg, 14 kg, 17 kg-trihydroxi-5 kg-androstan.
Figur 3. Nyckel hmbc (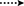 ) och COSY (
) och COSY ( ) korrelationer i nya metaboliter.
) korrelationer i nya metaboliter.
Figur 4. Viktiga noesy-korrelationer i nya metaboliter.
metabolit 3 erhölls som en vit fast substans. HREI-MS visade at m / z 318.2192 (calcd. 318.2195, C20H30O3). Detta representerade förlusten av heptanoat sidokedja, och tillsats av en syreatom i substrat 1. IR-spektrum visade absorbanser för OH (3,436 cm−1) och ketoniska karbonyler (1,711 cm−1). I 1H-NMR-spektrumet hittades signaler av heptanoatkedja och C-17-Metin-proton saknas, medan en ny Metin-protonsignal i nedfältet observerades vid 3,92 (Tabell 1) (datablad 3). Detta föreslog hydroxylering av steroidskelett och oxidativ klyvning av heptanoatdel. 13C-NMR-spektrumet stödde också ovanstående slutsatser. Kolsignaler för heptanoatdel hittades saknade, medan en ny ketonisk karbonyl och en oxy-Metin signaler uppträdde i 13C-NMR-spektrum (Tabell 1). Detta indikerade oxidativ klyvning av heptanoatkedja och hydroxylering i substrat 1. Den nyuppkomna metinproton vid 3,92 (h-7) visade hmbc-korrelationer med C-5 och C-8, vilket tyder på en OH vid C-7 (Figur 3). Hmbc-korrelationerna av H3-18 och H2-16 med ett kol vid 223,8 223,8 föreslog ett ketoniskt kol Vid C-17. OH at C-7 stöddes ytterligare av mysiga korrelationer av H-7 med H2-6 och H-8. H-7 (3.92, s) visade NOESY-korrelationer med axiellt orienterad H – 8 (1.70, överlappning), vilket föreslog en Oh-orientering av OH vid C-7 (Figur 4). Således härleddes strukturen av metabolit 3 som 2-oc-metyl-7-oc-hydroxi-5-oc-androstan-3,17-dion.
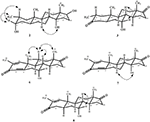
Enkristallröntgendiffraktionsanalyser utfördes också på föreningarna 1 och 5. Förening 1 bestod av fyra ringar, dvs A, B, C och D med stol, stol, stol och kuvertkonformationer. En metyl var närvarande vid C-2 med ekvatorial orientering. Heptanoatesterkedja var närvarande vid C-17 av ring D (Figur 6). Medan metabolit 5 innehåller ringar A, B, C och D i hyvel, stol, stol och kuvert konformationer. Heptanoat sidokedja saknades i metabolit 5 (Figur 7). Enkelkristalldiffraktionsdata för metaboliterna 1 och 5 skickades till Cambridge Crystallographic data Collection (CCDC 1500705 respektive CCDC 1500707). Enkelkristallröntgendiffraktionsanalysdata för föreningarna 1, 2 och 5 presenteras i Tabell 4.
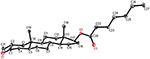
Figur 6. Datorgenererad ortep-ritning av slutlig Röntgenmodell av förening 1. Färgkoder: kol, svart; syre, röd.
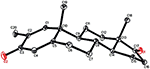
Figur 7. Datorgenererad ortep-ritning av slutlig Röntgenmodell av förening 5. Färgkoder: kol, svart; syre, röd.

tabell 4. Enkelkristallröntgendiffraktionsanalys av föreningar 1, 2 och 5.
cytotoxicitet mot HeLa, PC3, H640 och HCT116 Cancer och 3T3 normala cellinjer
naturliga produkter, t.ex. flavonoider, steroider, terpener etc. kan fungera som en utmärkt källa för produktion av många läkemedel, eftersom de rapporteras för många biologiska aktiviteter som anti-cancer, antiinflammatoriska, anti-leishmaniala, antibakteriella aktiviteter etc. Därför är det nödvändigt att derivatisera dem, för att studera struktur-aktivitetsförhållande som kan vara till hjälp för syntesen av säkra och effektiva läkemedel. För närvarande syntetiseras många farmaceutiska produkter effektivt via mikrobiell biotransformation på grund av närvaron av en rad enzymer i dem. Baserat på rapporterad anti-canceraktivitet av Drostanolon (9), drostanolonpropionat och Drostanolon heptanoat (1) utvärderades föreningar 1-9 för cytotoxicitet mot HeLa, PC-3, H460 och HCT116 cancercellinjer. Intressant visade alla föreningar en måttlig till potent anti-canceraktivitet. Anti-canceraktiviteten hos föreningar 1-9 härleddes från IC50-värdena mot HeLa (humant livmoderhalscancer), PC-3 (human prostatacancer), H460 (human lungcancer) och HCT116 (human koloncancer) (Tabell 5). Baserat på dessa resultat utvärderades cytotoxiciteten hos dessa föreningar också mot 3T3 (musfibroblast) normal cellinje, där alla föreningar, utom 8 (IC50 = 74,6 2,7 3,7) och 9 (IC50 = 62,1 1,2 1,2), befanns vara icke-cytotoxiska.

tabell 5. Cytotoxicitet av föreningar 1-9 mot HeLa, PC3, H460 och HCT116 cancer och 3T3 normala cellinjer.
struktur-Aktivitetsförhållande
variationer i metaboliternas strukturer påverkade deras anti-canceraktivitet. Metabolit 2 med frånvaro av esterdel, och två ao-h-grupper vid C-3, och C-14, och en ACC-h-grupp vid C-17 visade en lägre cytotoxicitet mot HeLa, H460, och HCT116 cancercellinjer, men dess anti-canceraktivitet var högre mot PC-3 cancercellinjen, jämfört med förening 1. Metabolit 3 med förlust av estergrupp och två ketogrupper vid C-3 och C-17 och Ao-H-grupp vid C-7 visade också en lägre aktivitet mot HeLa, H460 och HCT116 cancercellinjer, men ökad aktivitet mot PC-3 cancercellinje jämfört med substrat 1. Reduktion av C-3-karbonyl till O-H och hydrolytisk klyvning av esterdel i förening 4 ökade sin aktivitet mot både HeLa-och PC-3-cancercellinjer i viss utsträckning, men dess anti-canceraktivitet mot H460 och HCT116-cancercellinjer minskade jämfört med substrat 1. Närvaro av C = C mellan C-1/C-2 och C-4 / C-5, tillsammans med C = O vid C-3 och C-17 gjorde metabolit 5 till ett potent anti-cancermedel mot HeLa cancercellinjen, jämfört med substrat 1 och standardläkemedlet (cisplatin). Dessutom ökade dess anti-canceraktivitet mot PC-3-cancercellinjen också jämfört med substrat 1. Intressant var dess anti-canceraktivitet mot H460 och HCT116 cancercellinjer lägre jämfört med förening 1. Närvaro av C = C mellan C-1/C-2 och C-4 / C-5, C = O vid C-3 och C-17, tillsammans med ao-H-grupp vid C-11 i metabolit 6 ökade dess anti-canceraktivitet mot HeLa och PC-3 cancercellinjer jämfört med substrat 1 och visade liknande anti-cancerpotential mot HeLa cancercellinje som standardläkemedel (cisplatin). Emellertid minskade dess anti-canceraktivitet mot h460 och HCT116 cancercellinjer jämfört med förening 1. Närvaro av C = C mellan C-1/C-2 och C-4 / C-5, C = O vid C-3 och C-17, tillsammans med ao-H-grupp vid C-14 i metabolit 7 ökade igen sin anti-canceraktivitet mot HeLa och PC-3 cancercellinjer och minskade dess anti-canceraktivitet mot H460 och HCT116 cellinjer i jämförelse med substrat 1. Närvaro av C = C Vid C-1 / C-2, C = O vid C-3 och C-17 och aOH vid C-7 gjorde metabolit 8 till den mest potenta anti-cancer mot HeLa cancercellinjen jämfört med substrat 1 och standardläkemedlet (cisplatin). Det visade också en bra aktivitet mot PC – 3 cancercellinje men minskade anti-canceraktivitet mot H460 och HCT116 cancercellinjer jämfört med substrat 1. Metabolit 9 med endast hydrolys vid C-17 visade ökad anti-canceraktivitet mot HeLa, PC-3 och HCT116 cancercellinjer men minskade cytotoxicitet mot h460 cancercellinje jämfört med substrat 1 och standardläkemedlet (cisplatin). På grundval av ovanstående diskussion kan man dra slutsatsen att ökad anti-canceraktivitet av föreningar 5-8 mot HeLa och PC-3-cancercellinjer troligen berodde på närvaron av C = C Vid C-1/C-2 och karbonylketon vid C-3 och C-17 i jämförelse med substrat 1.
slutsats
Författarbidrag
konceptet presenterad forskning utvecklades och designades av MIC. MIC var också projektledare. Alla data analyserades och tolkades av MIC, A-t-W och HC. MS, SY, MA och NF utförde experimenten. MIC, A-T-W, och MS skrev manuskriptet. Alla författare reviderade manuskriptet. Den slutliga versionen av manuskriptet godkändes också av MIC före inlämning.
intressekonflikt uttalande
författarna förklarar att forskningen genomfördes i avsaknad av kommersiella eller finansiella relationer som kan tolkas som en potentiell intressekonflikt.
bekräftelser
A-T-W, och MIC erkänner den möjliggörande rollen för Higher Education Commission, Islamabad, Pakistan, genom ett ekonomiskt stöd under ”studier om kemoprevention av Bröstkarcinogenes av dietmedel, (20-3790/Nrpu/R&D/HEC/13/793).”SY erkänner det ekonomiska stödet från OPCW (Organisationen för förbud mot kemiska vapen) genom ett forskningsprojekt med titeln ”strukturella och biologiska studier om nya anabola steroider erhållna genom biotransformation.”HC erkänner det ekonomiska stödet från” Deanship of Scientific Research (DSR), King Abdulaziz University, utbildningsministeriet, Saudiarabien.”
kompletterande Material
Eastman, A. (1999). ”Verkningsmekanismen för cisplatin: från addukter till apoptos”, i Cisplatin: Kemi och biokemi av ett ledande läkemedel mot cancer, ed B. Lippert (Z Avsugningrich: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002 / 9783906390420. ch4
CrossRef fulltext / Google Scholar
Vardar, E., Vardar, sa och Cengiz, T. (2002). Anabola androgena steroider missbruk. Anato. J. Psykiatri 3, 104-107.