doseringsform: injektion
medicinskt granskad av Drugs.com. Senast uppdaterad den 22 Dec 2020.
- biverkningar
- dosering
- professionell
- interaktioner
- graviditet
- mer
endast Rx.
steril intravenös lösning
- Inamrinon beskrivning
- Inamrinon-klinisk farmakologi
- farmakokinetik
- farmakodynamik
- indikationer och användning för inamrinon
- kontraindikationer
- varningar
- försiktighetsåtgärder
- allmänt
- laboratorietester
- läkemedelsinteraktioner
- kemiska interaktioner
- karcinogenes, mutagenes, nedsatt fertilitet
- graviditet
- ammande mödrar
- pediatrisk användning
- biverkningar
- hantering av biverkningar
- överdosering
- Inamrinon dosering och administrering
- kemiska interaktioner
- hur levereras Inamrinon
- VIAL LABEL
- More about inamrinone
- Related treatment guides
Inamrinon beskrivning
Inamrinoninjektion USP representerar en ny klass av hjärt-inotropa medel som skiljer sig från digitalisglykosider eller katekolaminer. Inamrinonlaktat betecknas kemiskt som 5-Amino-6(1h)-ett 2-hydroxipropanat och har följande struktur:
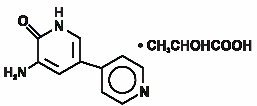
Inamrinon är en ljusgul kristallin förening med en molekylvikt av 187,20 och en molekylformel av C10H9N3O. varje mol mjölksyra har en molekylvikt av 90,08 och en empirisk formel för formel för c3h6o3. Lösligheterna för Inamrinon vid pH 4,1, 6,0 och 8,0 är 25, 0,9 respektive 0,7 mg/mL.
inamrinon injektion är en klar gul steril lösning tillgänglig i 20 mL injektionsflaskor för intravenös administrering. Varje mL innehåller Inamrinonlaktat motsvarande 5 mg Inamrinon och 0,25 mg natriummetabisulfit tillsatt som konserveringsmedel i vatten för injektion. Alla doser uttryckta i bipacksedeln uttrycks i termer av basen, Inamrinon. PH justeras till mellan 3,2 och 4,0 med mjölksyra eller natriumhydroxid. Den totala koncentrationen av mjölksyra kan variera mellan 5 mg och 7, 5 mg.
Inamrinon-klinisk farmakologi
Inamrinon är ett positivt inotropiskt medel med vasodilatatoraktivitet, olika i struktur och verkningssätt från antingen digitalisglykosider eller katekolaminer.
mekanismen för dess inotropa och vasodilaterande effekter har inte klarlagts fullständigt.
med avseende på dess inotropa effekt indikerar experimentella bevis att det inte är en beta-adrenerg agonist. Det hämmar myokardiell cyklisk adenosinmonofosfat (c-AMP) fosfodiesterasaktivitet och ökar cellulära nivåer av c-AMP. Till skillnad från digitalis hämmar det inte natrium-kaliumadenosintrifosfatasaktivitet.
med avseende på dess vasodilaterande aktivitet minskar Inamrinon afterload och förspänning genom sin direkta avslappnande effekt på vaskulär glatt muskel.
farmakokinetik
efter intravenös bolusinjektion (1 till 2 minuter) på 0, 68 mg/kg till 1, 2 mg/kg till normala frivilliga hade Inamrinon en distributionsvolym på 1, 2 liter/kg och efter en fördelningsfashalveringstid på cirka 4, 6 minuter i plasma hade en genomsnittlig uppenbar första ordningens terminal elimineringshalveringstid på cirka 3, 6 timmar. Hos patienter med hjärtsvikt som fick infusioner av Inamrinon var den genomsnittliga skenbara terminala eliminationshalveringstiden i första ordningen cirka 5,8 timmar.
Inamrinon har visats i en studie vara 10% till 22% bundet till humant plasmaprotein genom ultrafiltrering in vitro och i en annan studie 35% till 49% bundet av antingen ultrafiltrering eller jämviktsdialys.
den primära utsöndringsvägen hos människa är via urinen som både Inamrinon och flera metaboliter (N-glykolyl, N-acetat, O-glukuronid och N-glukuronid). Hos normala frivilliga utsöndrades cirka 63% av en oral dos av 14C-märkt Inamrinon i urinen under en 96-timmarsperiod. Under de första 8 timmarna var 51% av radioaktiviteten i urinen Inamrinon med 5% som N-acetat, 8% som N-glykolat och mindre än 5% för varje glukuronid. Cirka 18% av den administrerade dosen utsöndrades i avföring på 72 timmar.
i en 24-timmars icke-radioaktiv intravenös studie utsöndrades 10% till 40% av dosen i urinen som oförändrad Inamrinon med N-acetyl-metaboliten motsvarande mindre än 2% av dosen.
hos patienter med hjärtsvikt, efter en laddningsdos av bolus, kunde steady-state plasmanivåer på cirka 2, 4 mcg/mL bibehållas genom en infusion av 5 mcg/kg/min till 10 mcg/kg/min. Hos vissa patienter med hjärtsvikt, med tillhörande nedsatt njur-och leverperfusion, är det möjligt att plasmanivåerna av Inamrinon kan stiga under infusionsperioden; därför kan det hos dessa patienter vara nödvändigt att övervaka det hemodynamiska svaret och/eller läkemedelsnivån. De huvudsakliga måtten på patientens svar inkluderar hjärtindex, lungkapillär kiltryck, centralt venetryck och deras förhållande till plasmakoncentrationer. Dessutom kan mätningar av blodtryck, urinproduktion och kroppsvikt vara användbara, liksom sådana kliniska symtom som ortopedi, andfåddhet och trötthet.
farmakodynamik
hos patienter med deprimerad myokardfunktion ger Inamrinon en snabb ökning av hjärtutgången på grund av dess inotropa och vasodilatorverkan.
Efter en intravenös bolusdos av Inamrinon på 0.75 mg / kg till 3 mg/kg hos patienter med hjärtsvikt uppträder dosrelaterade maximala ökningar av hjärtproduktionen (cirka 28% vid 0, 75 mg/kg till cirka 61% vid 3 mg / kg). Toppeffekten sker inom 10 minuter vid alla doser. Effektens varaktighet beror på dos, varar ca 1/2 timme vid 0,75 mg/kg och ca 2 timmar vid 3 mg/kg.
över samma dosintervall visar lungkapillärkil tryck och total perifer resistens dosrelaterade minskningar (genomsnittliga maximala minskningar på 29% i lungkapillärkil tryck och 29% i systemisk vaskulär resistens). Vid doser upp till 3 mg/kg har dosrelaterade minskningar av diastoliskt tryck (upp till 13%) observerats. Medelartärtrycket minskar (9,7%) i en dos av 3 mg/kg. Hjärtfrekvensen är i allmänhet oförändrad.
förändringarna i hemodynamiska parametrar bibehålls under kontinuerlig intravenös infusion och i flera timmar därefter.
Inamrinon är effektivt hos helt digitaliserade patienter utan att orsaka tecken på hjärtglykosidtoxicitet. Dess inotropa effekter är additiva till digitalis. I fall av förmaksfladder / fibrillering är det möjligt att Inamrinon kan öka ventrikulär responsfrekvens på grund av dess lilla förbättring av A/V-ledning. I dessa fall rekommenderas tidigare behandling med digitalis.
förbättring av vänster ventrikulär funktion och lindring av kongestiv hjärtsvikt hos patienter med ischemisk hjärtsjukdom har observerats. Förbättringen har inträffat utan att inducera symtom eller elektrokardiografiska tecken på myokardiell ischemi.
vid konstant hjärtfrekvens och blodtryck ökar hjärtutgången utan mätbara ökningar av myokardiell syreförbrukning eller förändringar i arteriovenös syreskillnad.
inotrop aktivitet upprätthålls efter upprepade intravenösa doser av Inamrinon. Inamrinonadministration ger hemodynamiska och symptomatiska fördelar för patienter som inte kontrolleras tillfredsställande genom konventionell behandling med diuretika och hjärtglykosider.
indikationer och användning för inamrinon
inamrinoninjektion är för kortvarig hantering av kongestiv hjärtsvikt. På grund av begränsad erfarenhet och potential för allvarliga biverkningar (se biverkningar) ska Inamrinon endast användas till patienter som kan övervakas noggrant och som inte har svarat tillräckligt på digitalis, diuretika och/eller vasodilatatorer. Erfarenhet av intravenös Inamrinon i kontrollerade studier sträcker sig inte längre än 48 timmars upprepade bolusar och / eller kontinuerliga infusioner.
oavsett om det ges oralt, kontinuerligt intravenöst eller intermittent intravenöst, har varken Inamrinon eller någon annan cyklisk AMP-beroende inotrop i kontrollerade studier visat sig vara säker eller effektiv vid långvarig behandling av kongestiv hjärtsvikt. I kontrollerade studier av kronisk oral behandling med olika sådana medel (inklusive Inamrinon) lindrades symtomen inte konsekvent och de cykliska AMP-beroende inotroperna var konsekvent associerade med ökade risker för sjukhusvistelse och död. Patienter med NYHA klass IV-symtom tycktes ha särskild risk.
kontraindikationer
Inamrinon är kontraindicerat hos patienter som är överkänsliga mot det.
det är också kontraindicerat hos de patienter som är kända för att vara överkänsliga mot bisulfiter.
varningar
innehåller natriummetabisulfit, en sulfit som kan orsaka allergiska reaktioner inklusive anafylaktiska symtom och livshotande eller mindre allvarliga astmatiska episoder hos vissa mottagliga personer. Den totala förekomsten av Sulfitkänslighet i den allmänna befolkningen är okänd och förmodligen låg. Sulfitkänslighet ses oftare hos astmatiska än hos icke-astmatiska personer.
försiktighetsåtgärder
allmänt
Inamrinon ska inte användas till patienter med svår aorta-eller pulmonisk valvulär sjukdom i stället för kirurgisk lindring av obstruktionen. Liksom andra inotropa medel kan det förvärra obstruktion av utflödeskanalen vid hypertrofisk subaortisk stenos.
under intravenös behandling med Inamrinon övervakas blodtrycket och hjärtfrekvensen shouId och infusionshastigheten saktas eller stoppas hos patienter som uppvisar alltför stora blodtryckssänkningar.
patienter som har fått kraftig diuretikabehandling kan ha otillräckligt hjärtfyllningstryck för att svara tillräckligt på Inamrinon, i vilket fall försiktig liberalisering av vätske-och elektrolytintag kan indikeras.
supraventrikulära och ventrikulära arytmier har observerats i den mycket högriskpopulation som behandlats. Medan Inamrinon i sig inte har visat sig vara arytmogen, kan potentialen för arytmi, närvarande vid kongestiv hjärtsvikt i sig, ökas med något läkemedel eller en kombination av läkemedel.
trombocytopeni och levertoxicitet har noterats (se biverkningar).
användning vid akut hjärtinfarkt
inga kliniska prövningar har utförts på patienter i den akuta fasen av postmyokardiell infarkt. Därför rekommenderas inte Inamrinon i dessa fall.
laboratorietester
vätska och elektrolyter
vätske-och elektrolytförändringar och njurfunktion bör övervakas noggrant under Inamrinonbehandling. Förbättring av hjärtproduktionen med resulterande diuresis kan kräva en minskning av dosen av diuretikum. Kaliumförlust på grund av överdriven diurese kan predisponera digitaliserade patienter för arytmier. Därför bör hypokalemi korrigeras med kaliumtillskott före eller under användning av Inamrinon.
läkemedelsinteraktioner
i en relativt begränsad erfarenhet har inga ogynnsamma kliniska manifestationer observerats hos patienter där Inamrinon användes samtidigt med följande läkemedel: digitalisglykosider; lidokain, kinidin; metoprolol, propranolol; hydralazin, prazosin; isosorbiddinitrat, nitroglycerin; klortalidon, etakrynsyra, furosemid, hydroklortiazid, spironolakton; kaptopril; heparin, warfarin; kaliumtillskott; insulin; diazepam.
en fallrapport om överdriven hypotoni har rapporterats när Inamrinon användes samtidigt med disopyramid.
tills ytterligare erfarenhet finns tillgänglig ska samtidig administrering med disopyramid ske med försiktighet.
kemiska interaktioner
en kemisk interaktion sker långsamt under en 24-timmarsperiod när den intravenösa lösningen av Inamrinon blandas direkt med dextros (glukos)-innehållande lösningar. Inamrinon ska därför inte spädas med lösningar som innehåller dextros (glukos) före injektion.
en kemisk interaktion uppträder omedelbart, vilket framgår av bildandet av en fällning när furosemid injiceras i en intravenös linje av en infusion av Inamrinon. Därför bör furosemid inte administreras i intravenösa linjer som innehåller Inamrinon.
karcinogenes, mutagenes, nedsatt fertilitet
det fanns ingen antydan om en karcinogen potential med Inamrinon när det administrerades oralt i upp till två år till råttor och möss i dosnivåer upp till den maximalt tolererade dosen på 80 mg/kg/dag.
mikronukleustestet på mus (vid 7, 5 till 10 gånger den maximala humana dosen) och analysen av ovarialkromosomavvikelse från kinesisk hamster var positiva vilket indikerar både klastogenisk potential och undertryckande av antalet polykromatiska erytrocyter. Ames Salmonellaanalys, muslymfomstudie och odlad Human lymfocytmetafasanalys var dock alla negativa. De klastogena effekterna står i kontrast till negativa resultat som erhållits i fertilitetsstudierna hos han-och honråttor och en tregenerationsstudie på råttor, båda med oral dosering.
lätt förlängning av dräktighetsperioden på råtta sågs i dessa studier vid dosnivåer på 50 mg/kg/dag och 100 mg/kg / dag. Dystocia inträffade hos dammar som fick 100 mg/kg/dag vilket resulterade i ökat antal dödfödda, minskad kullstorlek och dålig överlevnad av valpar.
graviditet
teratogena effekter-graviditetskategori C
hos Nya Zeelands vita kaniner har Inamrinon visat sig ge fosterskelett och grova yttre missbildningar vid orala doser på 16 mg/kg och 50 mg/kg som var toxiska för kaninen. Studier på franska Hy / Cr-kaniner med orala doser upp till 32 mg/kg/dag bekräftade inte detta resultat. Inga missbildningar sågs hos råttor som fick inamrinon intravenöst vid den maximala dos som användes, 15 mg / kg / dag (ungefär den rekommenderade dagliga intravenösa dosen för patienter med hjärtsvikt). Det finns inga adekvata och välkontrollerade studier på gravida kvinnor. Inamrinon ska endast användas under graviditet om den potentiella nyttan motiverar den potentiella risken för fostret.
ammande mödrar
försiktighet bör iakttas när Inamrinon ges till ammande kvinnor, eftersom det inte är känt om det utsöndras i bröstmjölk.
pediatrisk användning
säkerhet och effektivitet hos barn har inte fastställts.
biverkningar
trombocytopeni: Intravenös injektion av Inamrinon resulterade i minskning av antalet blodplättar till under 100 000/mm3 eller normala gränser hos 2,4 procent av patienterna.
det är vanligare hos patienter som får långvarig behandling. Hittills, i noggrant övervakade kliniska prövningar, hos patienter vars trombocytantal inte fick förbli deprimerade, har inga blödningsfenomen observerats.
Trombocytreduktion är dosberoende och uppträder på grund av en minskning av trombocytöverlevnadstiden. Flera patienter som utvecklade trombocytopeni medan de fick Inamrinon hade benmärgsundersökningar som var normala. Det finns inga bevis som relaterar trombocytreduktion till immunsvar eller till en trombocytaktiverande faktor.
gastrointestinala effekter: gastrointestinala biverkningar rapporterade med Inamrinon under klinisk användning inkluderade illamående (1, 7%), kräkningar (0, 9%), buksmärta (0, 4%) och anorexi (0, 4%).kardiovaskulära effekter: kardiovaskulära biverkningar rapporterade med Inamrinon inkluderar arytmi (3%) och hypotoni (1, 3%).
levertoxicitet: Hos hundar, vid IV-doser mellan 9 mg/kg/dag och 32 mg/kg/dag, visade Inamrinon dosrelaterad hepatotoxicitet manifesterad antingen som enzymhöjning eller levercellnekros eller båda. Levertoxicitet har observerats hos människa efter långvarig oral dosering och har i begränsad erfarenhet (0,2%) observerats efter intravenös administrering av Inamrinon. Det har också förekommit sällsynta rapporter om enzym-och bilirubinhöjning och gulsot.
överkänslighet: det har förekommit rapporter om flera uppenbara överkänslighetsreaktioner hos patienter som behandlats med oralt Inamrinon i cirka två veckor. Tecken och symtom var varierande men inkluderade perikardit, pleurit och ascites (1 fall), myosit med interstitiell skuggning på röntgen på bröstet och förhöjd sedimenteringshastighet (1 fall) och vaskulit med nodulära lungdensiteter, hypoxemi och gulsot (1 fall). Den första patienten dog, inte nödvändigtvis av den möjliga reaktionen, medan de två sista löstes med avbrytande av behandlingen. Inget av fallen prövades på nytt så att tilldelningen av Inamrinon inte är säker, men möjliga överkänslighetsreaktioner bör övervägas hos alla patienter som upprätthålls under en längre period på Inamrinon.
allmänt: ytterligare biverkningar som observerats i intravenösa kliniska studier av inamrinon inkluderar feber (0, 9%), bröstsmärta (0, 2%) och brännande vid injektionsstället (0, 2%).
hantering av biverkningar
minskning av antalet blodplättar: Asymtomatisk minskning av antalet blodplättar (till <150 000/mm3) kan vändas inom en vecka efter en minskning av läkemedelsdosen. Vidare, utan förändring i läkemedelsdosering, kan räkningen stabiliseras vid lägre än pre-läkemedelsnivåer utan några kliniska följder. Trombocytantal före Läkemedel och frekventa trombocytantal under behandlingen rekommenderas för att hjälpa till vid beslut om dosändringar.
om ett trombocytantal mindre än 150 000 / mm3 inträffar kan följande åtgärder övervägas:
• behåll den totala dagliga dosen oförändrad, eftersom antalet i vissa fall antingen har stabiliserats eller återgått till förbehandlingsnivåer. * Minska den totala dagliga dosen. * Avbryt Inamrinon om, enligt läkarens kliniska bedömning, risken överstiger den potentiella nyttan.
gastrointestinala biverkningar: medan gastrointestinala biverkningar sågs sällan med intravenös behandling, skulle allvarliga eller försvagande sådana inträffa, kan läkaren vilja minska dosen eller avbryta läkemedlet baserat på de vanliga nytta-till-risk-övervägandena.
levertoxicitet: I klinisk erfarenhet hittills med intravenös administrering har hepatotoxicitet observerats i sällsynta fall. Om akuta markerade förändringar i leverenzymer uppträder tillsammans med kliniska symtom som tyder på en idiosynkratisk överkänslighetsreaktion, bör behandlingen med Inamrinon omedelbart avbrytas.
om mindre än markerade enzymförändringar inträffar utan kliniska symtom, bör dessa icke-specifika förändringar utvärderas individuellt. Läkaren kan vilja fortsätta Inamrinon, minska dosen eller avbryta läkemedlet baserat på de vanliga fördelarna/riskövervägandena.
överdosering
ett dödsfall har rapporterats med en massiv oavsiktlig överdos (840 mg under tre timmar genom initial bolus och infusion) av Inamrinon, även om orsakssambandet är osäkert. Noggrannhet bör utövas under produktberedning och administrering.
doser av Inamrinon kan ge hypotoni på grund av dess vasodilatoreffekt. Om detta inträffar bör administreringen av Inamrinon minskas eller avbrytas. Ingen specifik antidot är känd, men allmänna åtgärder för cirkulationsstöd bör vidtas.
hos råttor var LD50 av Inamrinon, som laktatsalt, 102 mg/kg eller 130 mg/kg intravenöst i två olika studier och 132 mg/kg oralt (intragastriskt); som en suspension i vattenhaltig gummitragakant var den orala LD50 239 mg/kg.
Inamrinon dosering och administrering
Laddningsdoser av inamrinoninjektion ska administreras enligt tillförsel (outspädd). Infusioner av Inamrinon kan administreras i normal eller halv normal saltlösning till en koncentration av 1 mg/mL till 3 mg/mL. Utspädda lösningar ska användas inom 24 timmar.
inamrinoninjektion kan administreras i löpande dextros (glukos) infusioner genom en Y-kontakt eller direkt i slangen där föredraget.
kemiska interaktioner
en kemisk interaktion sker långsamt under en 24-timmarsperiod när den intravenösa lösningen av Inamrinon blandas direkt med dextros (glukos)-innehållande lösningar. Inamrinon ska därför inte spädas med lösningar som innehåller dextros (glukos) före injektion.
en kemisk interaktion uppträder omedelbart, vilket framgår av bildandet av en fällning när furosemid injiceras i en intravenös linje av en infusion av Inamrinon. Därför bör furosemid inte administreras i intravenösa linjer som innehåller Inamrinon.
Följande procedur rekommenderas för administrering av inamrinoninjektion:
1. Initiera behandlingen med en laddningsdos på 0,75 mg/kg som ges långsamt under 2 till 3 minuter.
|
LOADING DOSE DETERMINATION 0.75 mg/kg (undiluted) |
||||||||||
|
Patient Weight in kg |
||||||||||
|
mL of undiluted Inamrinone Injection |
||||||||||
2. Continue therapy with a maintenance infusion between 5 mcg/kg/min and 10 mcg/kg/min.
3. Based on clinical response, an additional loading dose of 0.75 mg/kg may be given 30 minutes after the initiation of therapy.
4. Infusionshastigheten varierar vanligtvis från 5 mcg/kg/min till 10 mcg/kg/min så att den rekommenderade totala dagliga dosen (inklusive laddningsdoser) inte överstiger 10 mg / kg. Ett begränsat antal patienter som studerats vid högre doser stöder en dosregim upp till 18 mg/kg/dag för förkortad behandlingstid.
följande infusionshastighetstabell kan användas för att säkerställa att beräkningarna görs korrekt.
för att använda diagrammet måste koncentrationen av inamrinoninfusionslösning vara 2,5 mg/mL (2500 mcg / mL). Denna koncentration framställs genom att blanda Inamrinonlösningen med en lika stor volym utspädningsmedel (normal eller halv normal saltlösning).
| * utspädning: för att förbereda den 2, 5 mg/mL koncentration som rekommenderas för infusionsblandning Iamrinon med lika stor volym spädningsmedel. Blanda till exempel tre 20 mL injektionsflaskor med Inamrinon (3 x 20 mL = 60 mL) med 60 mL spädningsmedel för en total volym av 120 mL av den slutliga 2,5 mg/mL lösningen av Inamrinon. | ||||||||||
|
Inamrinone IV INFUSION RATE (mL/hr) CHART Using 2.5 mg/mL Infusion Concentration* |
||||||||||
|
Patient Weight in kg |
||||||||||
|
Dosage: 5.0 mcg/kg/min |
||||||||||
|
7.5 mcg/kg/min |
||||||||||
|
10.0 mcg/kg/min |
||||||||||
Example: A 70 kg patient would require a loading dose of 10.5 mL of undiluted Inamrinone. If the physician selects a dose of 7.5 mcg/kg/min för infusionen skulle flödeshastigheten vara 13 mL/timme vid 2, 5 mg/mL-koncentrationen av Inamrinon.
5. Administreringshastigheten och behandlingstiden bör justeras enligt patientens svar. Läkaren kan vilja minska eller titrera infusionen nedåt baserat på klinisk respons eller ogynnsamma effekter.
ovanstående doseringsregimer kan förväntas placera de flesta patienters plasmakoncentration av Inamrinon vid cirka 3 mcg/mL. Ökningar av hjärtindex visar ett linjärt förhållande till plasmakoncentrationen i intervallet 0.5 mcg / mL till 7 mcg / mL. Inga observationer har gjorts vid högre plasmakoncentrationer.
patientförbättring kan återspeglas av ökad hjärtutgång, minskning av lungkapillärkil tryck och sådana kliniska svar som en minskning av andnöd och en förbättring av andra symtom på hjärtsvikt, såsom ortopedi och trötthet.
övervakning av centralt venöst tryck (CVP) kan vara värdefullt vid bedömningen av hypotoni och vätskebalanshantering. Tidigare korrigering eller justering av vätska/elektrolyter är nödvändig för att uppnå tillfredsställande svar med Inamrinon.
parenterala läkemedel ska inspekteras visuellt och ska inte användas om partiklar eller missfärgning observeras.
hur levereras Inamrinon
Inamrinon injektion USP levereras i endosflaskor med 20 mL steril, klar gul lösning individuellt förpackad. NDC 55390-042-10.
varje 1 mL innehåller Inamrinonlaktat motsvarande 5 mg Inamrinon.
skydda mot ljus. Förpackningen är ljusbeständig för skydd under lagring. Förvara i kartong tills tiden för användning.
Förvara vid kontrollerad rumstemperatur 15 till 30 till C (59 till 86 till f).
Manufactured by: Manufactured for:
Ben Venue Laboratories, Inc. Bedford Laboratories™
Bedford, OH 44146 Bedford, OH 44146
August 2002 AMR-P01
VIAL LABEL

Vial Label 100 mg/20 mL
| Inamrinone Inamrinone injection |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
Labeler – Bedford Laboratories (884528407)
Registrant – Ben Venue Laboratories (004327953)
| Establishment | |||
| Name | Address | ID/FEI | Operations |
| Ben Venue Laboratories Inc. | 004327953 | MANUFACTURE(55390-042) | |
More about inamrinone
- Side Effects
- During Pregnancy
- Dosage Information
- Drug Interactions
- Drug class: inotropic agents
Related treatment guides
- Heart Failure
Medical Disclaimer