det första biologiska läkemedlet, humaniserat insulin (5,8 kDa), blev tillgängligt 1982 efter tillkomsten av bioteknik, och det markerade en ny era inom läkemedelsindustrin. Moderna framsteg inom bioteknik möjliggör storskaliga synteser av biologiska läkemedel på ett mer eller mindre kostnadseffektivt sätt. Efter att ha en gång börjat med stora peptider och rekombinanta proteiner inkluderar biologics numera ett brett spektrum av andra enheter, såsom antikroppar, monoklonala antikroppar och mer nyligen nanobodies och relaterade föremål, lösliga receptorer, rekombinant DNA, antikropp-läkemedelskonjugat (ADC), fusionsproteiner, immunterapi och syntetiska vacciner.
den ’stigande stjärnan’ av biologiska läkemedel har fångat ökad uppmärksamhet hos farmaceutiska proffs och branschanalytiker, eftersom detta alternativa läkemedelsupptäcktsparadigm representerar en betydande affärsutmaning för mer traditionella småmolekylära läkemedelsupptäcktsparadigm som definierar läkemedelsindustrin i mer än ett sekel.
så frågan uppstår: förlorar små molekyler ”attraktivitet” som forskningsobjekt för läkemedelsupptäckt i den moderna världen av biologiska framsteg? Vissa experter är fortfarande optimistiska om små molekylers potential att leda loppet i framtida farmaceutiska rörledningar, andra uppfattar att ”pengar byter fickor” och små molekylforskning kommer alltmer att försummas av aktieägare och investerare till förmån för biologiska läkemedel.
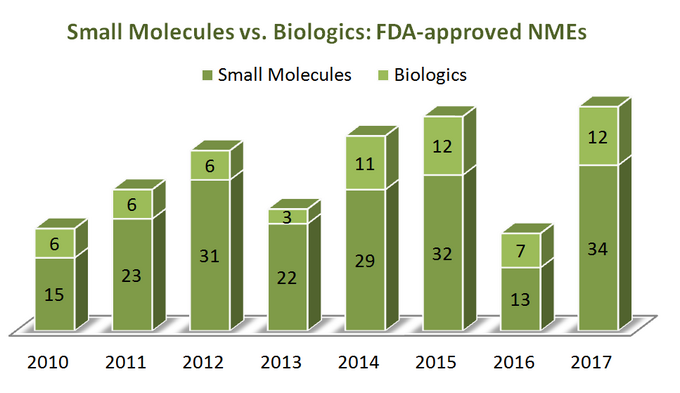
för att ta reda på var branschen är på väg, låt oss först börja med lite statistik. Under en period av 7 år (2010-2017) USA. Food and Drug Administration (FDA) godkände totalt 262 nya molekylära enheter (NME), exklusive flera diagnostiska avbildningsmedel och 1 insulinanalog (ref). Det verkar som om 76% av dem är små molekyler (199) med bara en fjärdedel som biologiska. Intressant, det finns ingen uppenbar tillväxt i biologics NMEs-godkännanden i förhållande till små molekyler, eftersom båda kategorierna av terapier trender på ett ganska liknande sätt, som visas på diagrammet nedan. Men eftersom biologics prissätts mycket annorlunda än små molekyler (de är mycket dyrare) är bilden annorlunda när man tittar på total försäljning och intäktstillväxt: under perioden 2011 till 2017 har biologiska försäljningsintäkter ökat med 70% efter att ha nått 232 miljarder dollar. Andelen av den totala läkemedelsmarknaden som biologiska läkemedel innehar ökade från 16% 2006 upp till 25% 2016, utan några uppenbara tecken på avmattning (ref).
även om det finns distinkta fördelar med biologics över små molekyler på flera sätt (till exempel deras djupa selektivitet), är saker inte” svartvita ” när man jämför dessa två kategorier av terapi med deras attribut, eftersom båda har betydande fördelar och nackdelar att överväga under strategiskt beslutsfattande. Så det verkar lite beklagligt att se hur många rapporter sidelined SMs jämfört med biologiska i en strävan efter ”friskhet” av sina synpunkter.
en tabell nedan sammanfattar några starka och svaga aspekter av båda kategorierna (ref, ref) som illustrerar utmaningar och möjligheter som finns i båda ” lägren ”(notera färger: grå – ingen uppenbar fördel i inget läger; grön-fördelaktig situation; gul-ofördelaktig situation):
små molekyler |
allmänna egenskaper |
|---|---|
|
lågmolekylära vikter (0,1 – 1 kDa); vanligtvis kemiskt och termiskt stabilt, brett polaritetsområde. |
mycket stora molekylvikter > 1 kDa; generellt polär, känslig för värme, lätt nedbruten (med undantag för vissa långlivade typer som monoklonala antikroppar) |
|
selektivitet, säkerhet |
|
|
snarare promiskuös, vanligtvis binda till olika off-target platser, rendering biverkningar eller toxicitet. slutligen, biologiska utvecklare har haft en lättare tid att få patent eftersom det var liten eller ingen state-of-art i fältet, när nuvarande blockbusters upptäcktes. |
mycket specifikt för målen, i allmänhet med lägre toxicitet (med ett stort undantag är immunogenicitet, vilket allvarligt kan påverka effektiviteten, säkerheten och dispositionen av biologiska läkemedel). |
|
cellpermeabilitet |
|
|
SMs binder med mål som G-proteinkopplade receptorer (GPCR), ligand-gated jonkanaler och receptortyrosinkinaser på de extracellulära eller intracellulära domänerna. De kan komma åt mål i de intracellulära regionerna, cytosoler, kärnor och till och med CNS-mål, åtskilda av den täta blod-hjärnbarriären (BBB). |
en stor del av farmakologiska mål är inbäddade och därför otillgängliga för biologiska läkemedel. Speciellt när det gäller centrala nervsystemet (CNS) är närvaron av blod-hjärnbarriären ett stort hinder på vägen för alla molekyler större än 600 Da som begränsar upp till 98% av SMs och praktiskt taget alla biologiska ämnen. |
|
leverans |
|
|
faller till stor del i ”regel om fem” för oral absorption, vilket gör den lämplig för oral leverans. Ytterligare permeabilitet via tarmepitel förmedlas främst av en kombination av passiv diffusion och paracellulär transport. |
inneboende instabilitet och högmolekylära massor gör nästan alla biologiska ämnen Oralt inaktiva. För det mesta, invasiv leverans eller alternativa icke-invasiva tekniker pågår. |
|
Distribution |
|
|
SMs distribueras via blodcirkulationen, vilket möjliggör att pick-koncentrationer snabbt uppnås. |
för större molekyler (t.ex. >10 kDa) blir ett långsammare (100-500 gånger) lymfsystem dominerande i distributionsprocessen. Större biologiska läkemedel distribueras via både blodet och lymfsystemet som rör sig konvektiv transport, receptormedierad endocytos, fagocytos och pinocytos. Det resultatet av denna situation är att större biologiska läkemedel har längre halveringstider, begränsade distributionsvolymer och behöver mer tid för att nå toppkoncentrationer jämfört med SMs. |
|
Disposition (metabolism) |
|
|
de flesta SMs bortskaffas av icke-riktade organ-via cytokrom eller icke-cytokrom metabolism, njurfiltrering eller fekal utsöndring. |
biologiska läkemedel har tätare interaktioner med mål, så deras dispositioner påverkas direkt av deras bindning (receptormedierad läkemedelsdisposition), inklusive clearanser av biologiska läkemedel av proteaser och peptidas. |
|
läkemedelsinteraktioner |
|
|
SMs är benägna att läkemedelsinteraktioner som kan uppstå på grund av närvaron av samtidiga läkemedel som påverkar deras transport -, metabolism–, transport-eller elimineringsvägar. |
biologiska läkemedel är mindre benägna att traditionella läkemedelsinteraktioner eftersom de genomgår metabolism och eliminering som endogena substrat. Det finns dock dokumenterade cytokinmedierade förändringar i läkemedelsmetaboliserande enzymer, därför måste läkemedelsbiologiska interaktioner bedömas om läkemedlet kan påverka uttrycket av metaboliska enzymer. |
|
affärsaspekter |
|
|
låga priser för SM-läkemedel. |
vanligtvis mycket höga priser för biologiska behandlingar. Detta betraktas som en av anledningarna till att biologiska läkemedel verkar ge bättre övergripande ekonomisk avkastning jämfört med SMs. |
|
hög avgångshastighet (2009-studie av KMR-gruppen visade att endast 7, 1% av SMs som kom in i preklinisk testning så småningom nådde marknaden). |
relativt låg avgångshastighet (samma KMR-gruppstudie avslöjade 24,4% av prekliniska biologer överlevde upp till marknadsstadiet). |
|
Severe competition from chemical generics after patents expiration. |
Biologics developers face less severe competition from biosimilars, after patents expiration. |
|
Simpler drug discovery/development process. |
More expensive and complex drug discovery and development process, compared to biologics. |
Med tanke på ovanstående jämförelse blir det uppenbart att biologiska läkemedel inte är en ”magisk kula” och industrin kommer inte att domineras av biologiska läkemedel inom överskådlig framtid, snarare kommer en konkurrenskraftig jämvikt att bibehållas mellan små molekyler, biologiska och hybridformer av terapi, såsom ADC-med lokal dominans av varje form i mer lämpliga terapeutiska områden, användningsfall etc.
dessutom nedan är en lista över flera branschförare som spelar på sidan av små molekyler och kan påverka maktbalansen på den totala läkemedelsmarknaden till förmån för kemiska utgångspunkter:
ökningen av artificiell intelligens (AI) i läkemedelsupptäckt
efter genombrott i djupa inlärningsalgoritmer (2012) och mer nyligen, skapande av generativa kontradiktoriska nätverk (gan), som kan utmärka sig i ett antal forskningsuppgifter, har intresset för olika AI-tekniker skjutit i höjden i mycket varje bransch. Många AI-drivna verktyg har snabbt blivit kommersiella mainstream, som chatbots, personliga assistenter, autopiloter etc.– vilket är ett verkligt bevis på begreppet AI-genomförbarhet.
läkemedelsupptäckt är inte ett undantag från denna ”AI-drivna trend”, och antalet startups som försöker tillämpa AI för att öka läkemedelsupptäckten på olika sätt har ökat väsentligt under bara flera år, efter att ha nått över hundra aktiva företag hittills (här är en lista över några av dem).
intressant är att majoriteten av AI-drivna startups är inriktade på små molekyler läkemedelsupptäckt, snarare än biologiska, vilket förmodligen inte är förvånande. Historiskt användes även icke-AI-beräkningsmetoder (keminformatik) främst för småmolekylära terapier på grund av deras väsentligt enklare molekylära strukturer och interaktionsmönster.
nedanstående diagram visar en uppskattad statistik för 61 aktivt marknadsförda läkemedelsupptäcktsstarter som utvecklar eller tillämpar specialiserade AI-verktyg i sitt forskningsarbetsflöde. Som du kan se är hälften av alla företag (51%, 31 startups) inriktade på små molekyler, medan endast 23% (14 startups) är involverade i att upptäcka/utveckla biologiska läkemedel (antikroppar, vacciner etc). Disproportionen mot små molekyler illustreras också väl av mängden VC-finansiering som samlats in av 61 granskade AI-drivna startups (endast offentliggjorda rundor) – där 770 miljoner investerades i de företag som är involverade i små molekyler och endast drygt 200 miljoner tilldelades för biologiska fokuserade startups-som visas nedan.
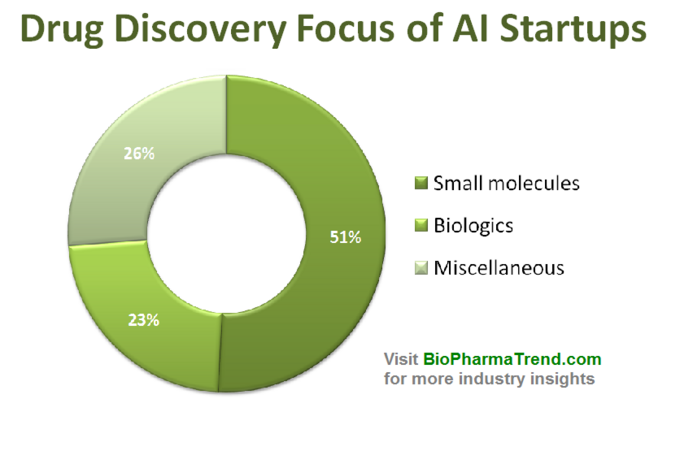
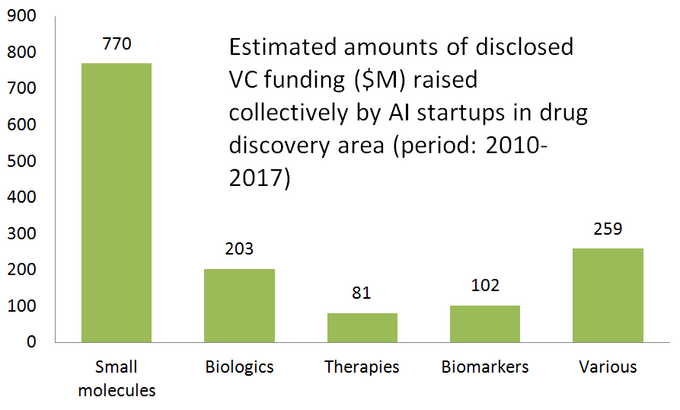
denna situation tyder på att de senaste framstegen inom AI algoritmer och en trend att tillämpa maskininlärning för tidigt stadium farmaceutisk forskning tenderar att driva mer tillväxt i små molekyler läkemedel upptäckt, jämfört med biologiska upptäckt-åtminstone för nu. Detta kan leda till fler framtida investeringar i små molekylfokuserade projekt som stöds av AI-driven teknik.
nå ”undruggable” mål
sådana viktiga mål som till exempel protein-protein-interaktioner (PPI) domineras traditionellt av biologiska (mAbs) som potentiella aktörer, medan små molekyler länge hade ansetts olämpliga i detta fall på grund av deras lilla storlek.
med framstegen inom farmakogenomik kan denna situation förändras ganska snabbt efter godkännandena maraviroc (514 Da) och tirofiban (441 Da). Det avslöjades beräkningsmässigt att SMs faktiskt kan ha relativt höga affiniteter till specifika gränssnitt av proteiner och, viktigare, de kan modulera de ’inneboende störda proteinregionerna’ kopplade till en uppsättning komplexa systemsjukdomar. Här är en intressant täckning av detta ämne som sammanfattar några av de viktiga insikterna i PPI-maskiner som erhållits under de senaste decennierna.
ett annat snabbt växande område för upptäckt av små molekyler riktar sig mot ribonukleinsyra (RNA). Detta ämne listades i ”Top 7 Trends In Pharmaceutical Research In 2018”, och det fanns också en detaljerad granskning av ämnet i Cellkemisk biologi och en fin industri täcka upp i C&EN.
en annan ny ide för att frigöra kraften hos små molekyler diskuterades i en nyligen publicerad artikel ”riktade proteinnedbrytare omdefinierar hur små molekyler ser ut och agerar”publicerad i C&EN i 2018. Strategin här är att utveckla bifunktionella små molekyler som kan dirigera ett riktat protein helt och hållet till proteasom, cellens skräp-borttagningsmaskin, istället för att bara hämma proteinets verkan som i en traditionell metod.
övervinna begränsningar av screeningteknologier
mycket forskningspotential för små molekyler har ännu inte realiserats på grund av olika tekniska begränsningar av screeningmetoder som används för att identifiera utgångspunkter i läkemedelsupptäcktsprogram.ett sådant exempel är fenotypisk screeningmetod, som upplever renässans nuförtiden på grund av flera tekniska framsteg, inklusive den ökande förmågan att utveckla fysiologiskt relevanta cellmodeller, avläsningar och sofistikerade detekteringstekniker som hjälper till att avslöja verkningsmekanismer (MoA) mer effektivt, vilket minimerar osäkerheten. Å andra sidan erbjuder implementeringen av storskaliga profileringstekniker och beräkningsmetoder en ny nivå av systemanalys och förståelse för fenotyper med små molekyler.
ett annat lovande screeningparadigm är genom att använda DNA-kodade bibliotek (DELs). På grund av sitt unika arrangemang ger DEL-tekniken ett lämpligt sätt att testa hundratals miljoner och till och med miljarder nya molekyler i målbaserade läkemedelsupptäcktsprogram. Även om denna teknik inte är utan utmaningar (t.ex. begränsningar av DNA-kompatibel Kemi, osäkerhet med screeningträffar etc.) växer området snabbt och betraktas till och med som ’revolutionerande’ för upptäckt av små molekyler.
övervinna synthesizability barrier
en av de snubblande stenarna i tidig upptäckt av småmolekylära läkemedel är en begränsning av syntetiskt tillgängligt kemiskt utrymme-medan många lovande kemiska ideer kan genereras beräkningsmässigt eller annars finns det alltid en risk att syntetisering av hela uppsättningen föreningar för att validera sådana ideer skulle vara kostsamt eller till och med omöjligt.
senaste framsteg inom detta område har gjorts, igen, med hjälp av AI-baserad programvara som erbjuder syntesplanering på mänsklig nivå. Till exempel publicerade BenevolentAI nyligen ett papper i Nature, som beskriver hur de använde djupa neurala nätverk i kombination med moderna trädsökningsalgoritmer för att planera syntesen av nya molekyler med anmärkningsvärd framgångsgrad och hastighet.
flera intressanta omslag med rika kommentarer publicerades här och här av Derek Lowe som ger lite mer inblick i detta fascinerande område av organisk och medicinsk kemi.
en mer empirisk strategi utvecklades av en kemisk producent Enamine, som är känd som REAL Chemical Space, och omfattar för närvarande över 3.8 miljarder syntetiskt tillgängliga och sökbara molekyler för träffutforskning och andra medicinska kemiuppgifter. Konceptet kokar ner till att tillämpa en uppsättning interna validerade kemiska vägar (över 100 reaktioner) till en stor pool av kemiska byggstenar som finns i eget lager (över 100 tusen föreningar)-i syfte att kombinera dem på kombinatoriskt sätt för att producera en kaskad av större ”blyliknande” eller ”läkemedelsliknande” molekyler. När en viss grad av reproducerbarhet och utbyte uppnås i en tillräckligt stor uppsättning experiment (minst 80%) sker en ytterligare beräkningsräkning för att bygga upp ett bredare kemiskt utrymme baserat på de experimentellt validerade Fallen.
ny R &d marknader och roller för små molekyler
sammantaget kan man förbise eller missförstå storleken och tillväxtpotentialen hos små molekyler rörledningar, som nämndes under en paneldiskussion på Interphex. För närvarande är cirka 8000 små molekyler aktiva i R&D, en tillväxt på 25% under de senaste par åren. Ovanstående tillväxtdrivare kan leda till en ytterligare accelererad tillväxt inom denna sektor.
det är också viktigt att notera att småmolekylära läkemedel kan spela en viktig roll i vissa nästa generations läkemedel, vilket gör dem beroende av småmolekylära rörledningar. Till exempel, när det gäller stamcellsterapi, kan små molekyler utlösa terapeutiska reaktioner.
som framhävdes under Cphi Nordamerika av Milliporesigmas Jeffrey Shumway, tenderar små molekylprodukter att bli mer komplexa och förändra sin roll i (bio)läkemedelsindustrin.slutligen är det framtida området för små molekyler antikropp-läkemedelskonjugat och relaterade objekt, som framkom som en lovande klass av terapi på grund av naturlig konvergens av två läkemedelsupptäcktsparadigmer och flera tekniska trender.
ansvarsfriskrivning: informationen är endast för allmän medvetenhet och är inte en juridisk/finansiell/aktiehandel/medicinsk rådgivning av något slag. Du läser den på egen vilja och all användning av denna information sker på egen risk. Det är ditt ansvar att utvärdera användbarheten och säkerheten för informationen i det här inlägget, och Internet i allmänhet, och hur det gäller din egen situation och sedan konsultera relevanta experter för professionell rådgivning om det behövs.
ämnen: branschtrender