
Sau (Larry) Lee, Ph.D., biträdande chef för kontoret för testning och forskning, och ordförande för Emerging Technology Team, Office of Pharmaceutical Quality, CDER
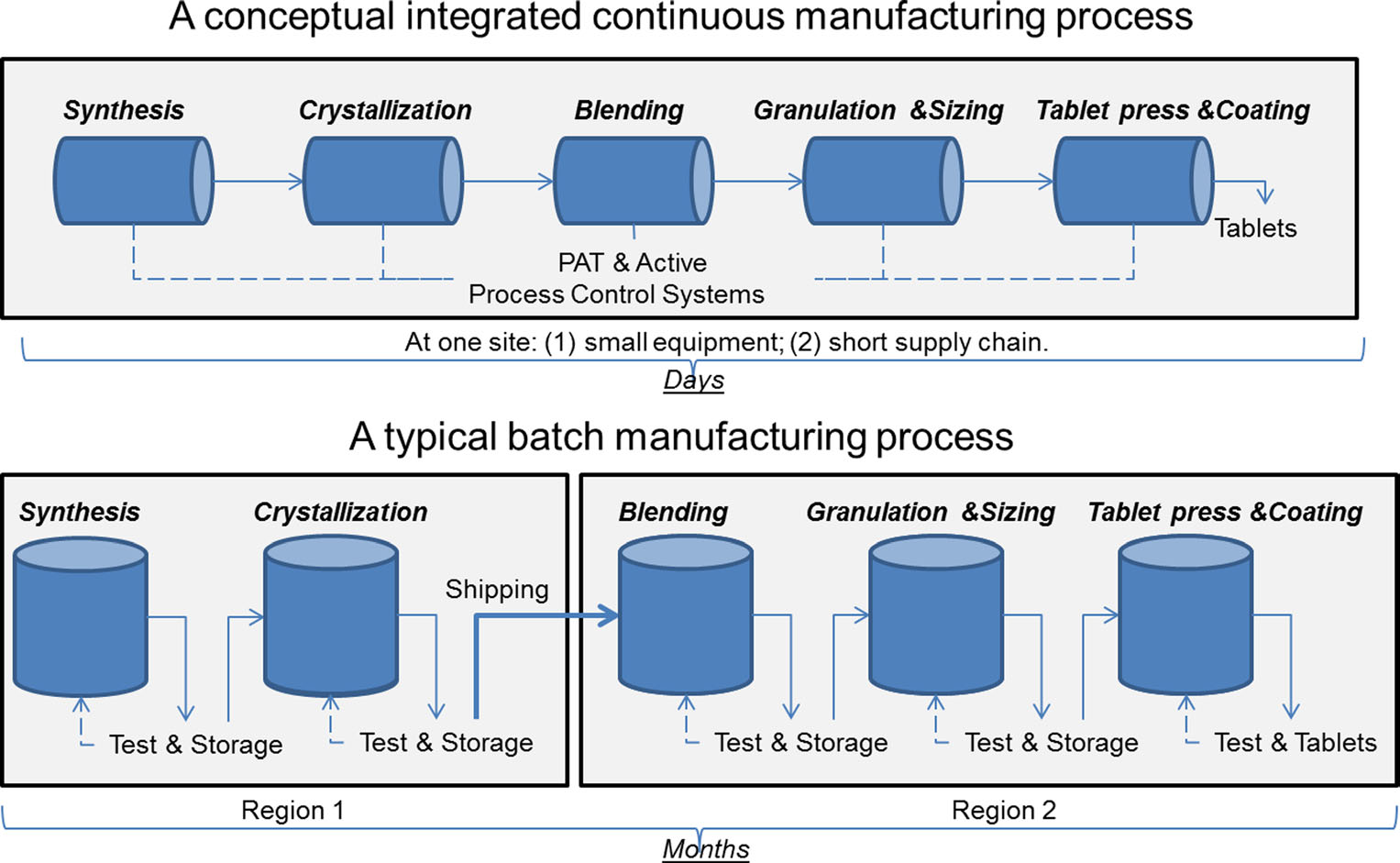 en jämförelse av kontinuerlig tillverkning och batchtillverkning. Bild med tillstånd av Sau Lee. J. Pharm Innov (2015) 10:191-199.
en jämförelse av kontinuerlig tillverkning och batchtillverkning. Bild med tillstånd av Sau Lee. J. Pharm Innov (2015) 10:191-199.i mer än 50 år har läkemedel producerats med en metod som kallas ”batch manufacturing”, en flerstegs, lång process som innebär användning av ungainly, storskalig utrustning. De senaste framstegen inom tillverkningsteknik har dock föranlett läkemedelsindustrin att överväga att flytta från batchtillverkning till en snabbare och effektivare process som kallas kontinuerlig tillverkning. FDA vidtar proaktiva åtgärder för att underlätta läkemedelsindustrins implementering av ny teknik, inklusive kontinuerlig tillverkning, för att förbättra produktkvaliteten och ta itu med många av de bakomliggande orsakerna till läkemedelsbrist och återkallelser.
Batch vs kontinuerlig tillverkning
Batchtillverkning innefattar flera diskreta steg. Efter varje steg i processen stannar produktionen vanligtvis så att prover kan testas offline för kvalitet. Ibland under dessa ”hålltider” mellan stegen kan materialet lagras i behållare eller skickas till andra anläggningar runt om i världen för att slutföra tillverkningsprocessen. Detta kan lägga till veckor eller månader till behandlingstiden. För vissa aktiva ingredienser som är känsliga för miljön kan det också medföra risk för nedbrytning. Dessutom, om efterfrågan på ett visst läkemedel ökar, kan ökad produktion kräva större utrustning. Denna uppskalning av utrustning kräver mer fysiskt utrymme, ett större fotavtryck och mer tid och pengar.
däremot flyttas läkemedel som tillverkas med kontinuerlig tillverkning nonstop inom samma anläggning, vilket eliminerar hålltider mellan steg. Material matas genom en monteringslinje av helt integrerade komponenter. Denna metod sparar tid, minskar sannolikheten för mänskliga fel och kan reagera mer smidigt på marknadsförändringar. För att ta hänsyn till högre efterfrågan kan kontinuerlig tillverkning pågå under en längre tid, vilket kan minska sannolikheten för läkemedelsbrist.
båda typerna av tillverkning omfattas av samma kvalitetskontrollstandarder, men övervakningen automatiseras i kontinuerliga tillverkningsanläggningar och tenderar att vara vanligare än vid batchtillverkning. Liksom all teknik kan kontinuerlig tillverkningsutrustning uppleva slitage, men automatiserad övervakning kan upptäcka problem långt innan ett fel uppstår. Sådan övervakning kan också bidra till att förutsäga livslängden för en utrustning, vilket leder till bättre proaktivt underhåll.
slutligen kan kontinuerlig tillverkning möjliggöra mer flexibel spårning och spårning, vilket skulle vara en fördel vid produktfel. Till exempel vid batchtillverkning definieras en specifik kvantitet (eller sats) av ett läkemedel av storleken på den utrustning som producerade den. Vid kontinuerlig tillverkning kan en kvantitet (eller sats) avgränsas med en tidsstämpel, mängd läkemedel som produceras eller mängden råinmatningsmaterial. Dessa spårningsmetoder tillåter tillverkaren att isolera en mindre mängd defekt material i händelse av ett processfel, vilket leder till mindre avfall och mindre risk för brist.
en utmanande men värdefull övergång
flera branscher—som den kemiska och petrokemiska industrin—har redan genomgått en tillverkningsutveckling och använder effektiv kontinuerlig teknik för att säkert tillverka produkter. Men för läkemedelsindustrin är övergången till kontinuerlig tillverkning fortfarande i sina tidiga skeden av flera skäl. För det första kan startkostnaderna för en sådan övergång vara höga. Att gå i pension med gammal batchutrustning, köpa ny teknik och utbilda personal om hur man använder den och modernisera industrins Infrastruktur är dyrt, vilket kräver ett allvarligt engagemang från en drogtillverkare. Ändå har ekonomiska analyser visat potentiella betydande långsiktiga besparingar. Dessutom måste vissa tekniker fortfarande mogna innan de är kommersiellt lönsamma. För vissa typer av läkemedel, såsom biologiska produkter, kan tekniken för att producera dem genom kontinuerlig tillverkning ännu inte existera. Forskning pågår för att ta itu med dessa och andra utmaningar. Dessutom uppfattar läkemedelstillverkare fortfarande regulatorisk osäkerhet som kan försena produktgodkännandet när en ny tillverkningsteknik används.
När branschen överväger hur man gör övergången, tillhandahåller FDA resurser och information för att underlätta övergången. Till exempel samarbetar byrån med Biomedical Advanced Research and Development Authority, ett program inom US Department of Health and Human Services, för att hjälpa till att finansiera och stödja forskning inom detta område. Vi utbildar också vår granskningspersonal och bedriver intern forskning om riskområden som är förknippade med kontinuerlig tillverkning, så att vi bättre kan bedöma relaterad teknik.
Jag leder ett tvärvetenskapligt team under Emerging Technology-programmet i CDER: s kontor för farmaceutisk kvalitet. Programmet inrättades för att hjälpa industrin att implementera innovativ teknik för att förbättra produktkvaliteten och modernisera industrin, i ett försök att ta itu med de bakomliggande orsakerna till läkemedelsbrist eller återkallelser. Emerging Technology-programmet behandlar inte bara kontinuerlig tillverkningsteknik utan även andra framsteg som 3D-utskrift, nya doseringsformer och nya containersystem. Under detta program, Vi samarbetar med industrin tidigt i processen att utveckla ny teknik, och diskutera eventuella förväntade reglerande eller vetenskapliga frågor som kan vara en del av en framtida tillämpning.
många företag har ansökt om Emerging Technology-programmet angående deras intresse för kontinuerlig tillverkning. FDA-dokumentet med titeln Advancement of Emerging Technology Applications to Modernize the Pharmaceutical Manufacturing Base Guidance for Industry ger information och råd om hur man arbetar med byrån tidigt i utvecklingsprocessen.
Läs mer om FDA: s ansträngningar att modernisera läkemedelstillverkningen i FDA: s Röstblogg.