
Sau (Larry) Lee, Ph.D., Directeur adjoint du Bureau des essais et de la recherche, et Président de l’équipe des technologies émergentes, Office of Pharmaceutical Quality, CDER
 Une comparaison de la fabrication continue et de la fabrication par lots. Image reproduite avec l’aimable autorisation de Sau Lee. J. Pharm Innov (2015) 10:191-199.
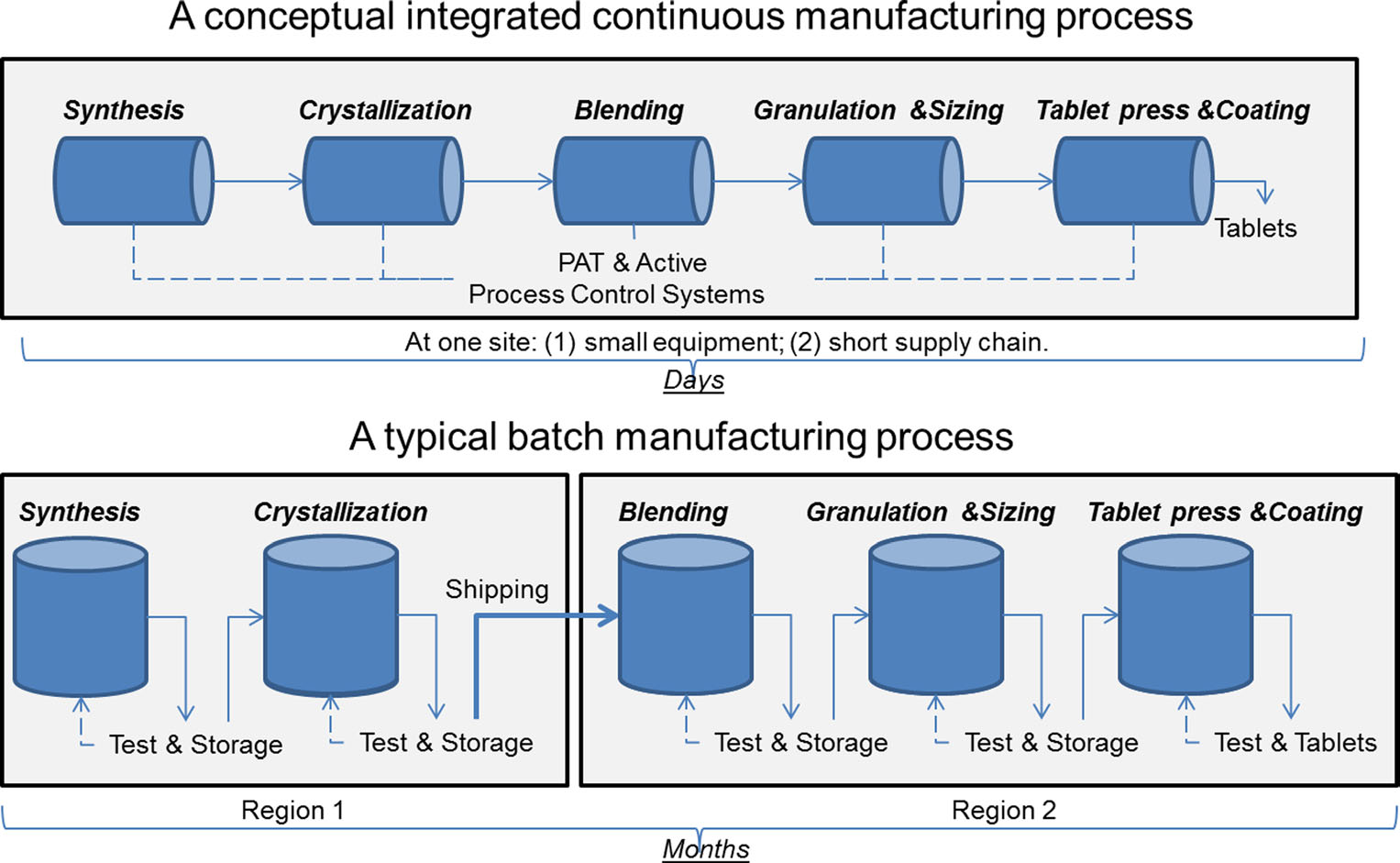
Une comparaison de la fabrication continue et de la fabrication par lots. Image reproduite avec l’aimable autorisation de Sau Lee. J. Pharm Innov (2015) 10:191-199.Depuis plus de 50 ans, les produits pharmaceutiques sont produits selon une méthode connue sous le nom de » fabrication par lots », un processus long et en plusieurs étapes qui implique l’utilisation d’équipements à grande échelle non essentiels. Cependant, les progrès récents de la technologie de fabrication ont incité l’industrie pharmaceutique à envisager de passer de la fabrication par lots à un processus plus rapide et plus efficace appelé fabrication continue. La FDA prend des mesures proactives pour faciliter la mise en œuvre par l’industrie pharmaceutique de technologies émergentes, y compris la fabrication continue, afin d’améliorer la qualité des produits et de s’attaquer à bon nombre des causes sous-jacentes des pénuries et des rappels de médicaments.
Fabrication par lots par rapport à la fabrication en continu
La fabrication par lots comporte plusieurs étapes discrètes. Après chaque étape du processus, la production s’arrête généralement afin que les échantillons puissent être testés hors ligne pour la qualité. Parfois, pendant ces « temps de rétention » entre les étapes, le matériau peut être stocké dans des conteneurs ou expédié à d’autres installations du monde entier pour terminer le processus de fabrication. Cela peut ajouter des semaines ou des mois au temps de traitement. Pour certains principes actifs sensibles à l’environnement, cela peut également introduire un risque de dégradation. De plus, si la demande pour un certain médicament augmente, une production accrue peut nécessiter un équipement plus important. Cette mise à l’échelle de l’équipement nécessite plus d’espace physique, une plus grande empreinte, ainsi que plus de temps et d’argent.
En revanche, les produits pharmaceutiques fabriqués en fabrication continue sont déplacés sans arrêt dans la même installation, ce qui élimine les temps de rétention entre les étapes. Le matériau est alimenté par une chaîne de montage de composants entièrement intégrés. Cette méthode permet de gagner du temps, de réduire les risques d’erreur humaine et de réagir plus facilement aux changements du marché. Pour tenir compte de la demande plus élevée, la fabrication continue peut durer plus longtemps, ce qui peut réduire la probabilité de pénuries de médicaments.
Les deux types de fabrication sont soumis aux mêmes normes de contrôle de la qualité, mais la surveillance est automatisée dans les installations de fabrication en continu et tend à être plus fréquente que dans la fabrication par lots. Comme toute technologie, les équipements de fabrication en continu peuvent subir une usure, mais la surveillance automatisée peut détecter les problèmes bien avant qu’une panne ne se produise. Une telle surveillance peut également aider à prédire la durée de vie d’un équipement, ce qui permet une meilleure maintenance proactive.
Enfin, la fabrication continue peut permettre un suivi et un traçage plus flexibles, ce qui serait un avantage en cas de défaillance du produit. Par exemple, dans la fabrication par lots, une quantité spécifique (ou un lot) d’un médicament est définie par la taille de l’équipement qui l’a produit. Dans la fabrication continue, une quantité (ou un lot) peut être délimitée par un horodatage, la quantité de médicament produite ou la quantité de matière première. Ces méthodes de suivi permettent au fabricant d’isoler une plus petite quantité de matériel défectueux en cas de défaillance du processus, ce qui entraîne moins de déchets et moins de risques de pénurie.
Une transition difficile mais intéressante
Plusieurs industries – telles que les industries chimiques et pétrochimiques – ont déjà connu une évolution de fabrication et utilisent des technologies continues efficaces pour fabriquer des produits en toute sécurité. Mais pour l’industrie pharmaceutique, la transition vers la fabrication continue en est encore à ses débuts pour plusieurs raisons. Premièrement, les coûts de démarrage d’une telle transition peuvent être élevés. Le retrait de l’ancien équipement de lot, l’achat de nouvelles technologies et la formation du personnel sur la façon de l’utiliser, et la refonte de l’infrastructure de l’industrie sont coûteux, ce qui nécessite un engagement sérieux de la part d’un fabricant de médicaments. Pourtant, les analyses économiques ont montré des économies potentielles importantes à long terme. De plus, certaines technologies doivent encore mûrir avant d’être commercialement viables. Pour certains types de médicaments, tels que les produits biologiques, la technologie permettant de les produire par fabrication continue peut ne pas encore exister. Des recherches sont en cours pour relever ces défis et d’autres. De plus, les fabricants de médicaments perçoivent toujours une incertitude réglementaire qui peut retarder l’approbation du produit lorsqu’une nouvelle technologie de fabrication est utilisée.
Alors que l’industrie réfléchit à la façon de faire le changement, la FDA fournit des ressources et des informations pour faciliter la transition. Par exemple, l’agence s’associe à la Biomedical Advanced Research and Development Authority, un programme du département de la Santé et des Services sociaux des États-Unis, pour aider à financer et à soutenir la recherche dans ce domaine. Nous formons également notre personnel d’examen et effectuons des recherches internes sur les domaines à risque associés à la fabrication continue, afin de mieux évaluer les technologies connexes.
Je dirige une équipe multidisciplinaire dans le cadre du Programme des Technologies émergentes au Bureau de la Qualité pharmaceutique du CDER. Le programme a été créé pour aider l’industrie à mettre en œuvre des technologies novatrices pour améliorer la qualité des produits et moderniser l’industrie, dans le but de s’attaquer aux causes sous-jacentes des pénuries de médicaments ou des rappels de médicaments. Le Programme des technologies émergentes aborde non seulement les technologies de fabrication continue, mais également d’autres avancées telles que l’impression 3D, les nouvelles formes posologiques et les nouveaux systèmes de conteneurs. Dans le cadre de ce programme, nous collaborons avec l’industrie au début du processus de développement de nouvelles technologies et discutons de tout problème réglementaire ou scientifique prévu qui pourrait faire partie d’une application future.
De nombreuses entreprises ont postulé au Programme des technologies émergentes en ce qui concerne leur intérêt pour la fabrication continue. Le document de la FDA intitulé Advancement of Emerging Technology Applications to Modernize the Pharmaceutical Manufacturing Base Guidance for Industry fournit des informations et des conseils sur la façon de travailler avec l’agence au début du processus de développement.
En savoir plus sur les efforts de la FDA pour moderniser la fabrication de médicaments dans le blog Voice de la FDA.