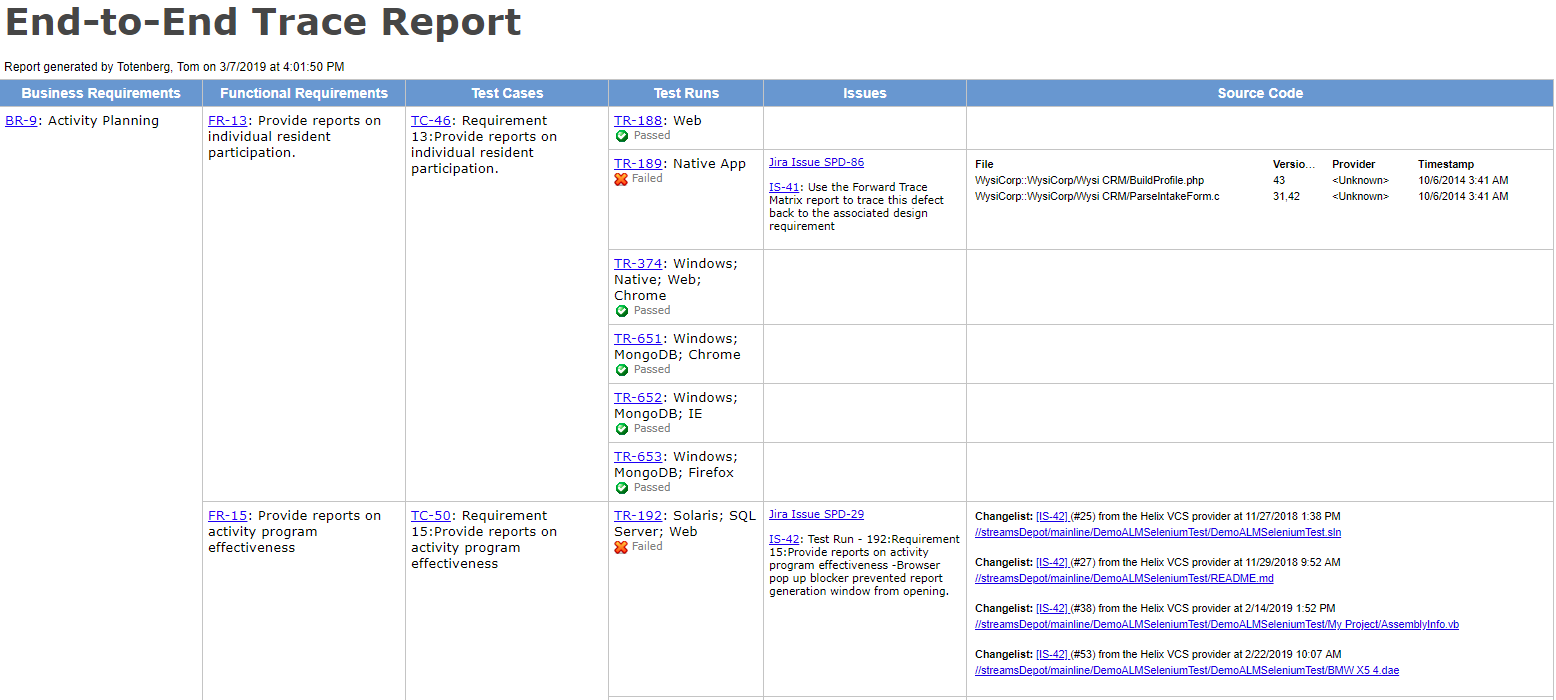
Si vous développez des produits — en particulier des dispositifs médicaux —, vous avez entendu les termes validation de la conception et vérification de la conception (également appelés V & V). Ici, nous vous expliquerons quelles sont les deux activités, la différence entre elles, ainsi que des conseils pour tirer le meilleur parti de vos efforts.
Remarque: Pour valider que ce contenu vous serait utile, nous nous sommes mis en relation avec Megan Martin, une consultante du dispositif médical V&V avec plus de 30 ans d’expérience dans le dispositif médical V&V, le logiciel du dispositif médical, la qualité des produits et des logiciels, et les soumissions réglementaires des dispositifs aux États-Unis et à l’étranger. Vous trouverez ses idées et ses exemples tout au long!
Suivez ou passez à la section que vous recherchez :
- Validation de la Conception vs Vérification de la Conception
- Qu’est-ce que la Validation de la Conception Exactement?
- Qu’est-ce que la Vérification de la conception pour la FDA?
- Résumé de la Validation vs de la Vérification
- Bases du Processus de Validation de la Conception
- Bases du Processus de Vérification de la Conception
- 6 Conseils pour une Meilleure Validation&Vérification
- Vidéo: Simplifiez V & V
- V &V: Glossaire des termes
- Validation de la conception vs Vérification de la conception : Quelle est la différence ?
- Qu’Est-Ce Que La Validation De Conception Exactement ?
- Exemple de validation de conception
- Besoin de l’utilisateur
- Qu’est-ce que la Vérification de conception pour la FDA?
- Exemple de vérification de la conception
- Exigences du produit
- Spécifications de conception
- Résumé de la validation par rapport à la vérification
- Bases du processus de validation de la conception
- Principes de base du processus de vérification de la conception
- Identifier et préparer
- Planification
- Développement
- Exécution
- Reporting
- 6 Conseils pour une meilleure validation &Vérification
- Planifiez à l’avance (Et Testez Tôt)
- Utiliser la nomenclature partagée
- Utilisez des Outils Avec une Traçabilité de bout en bout
- Construisez Votre Matrice de traces Au fur et à mesure
- Intégrer la traçabilité des exigences &Tester avec suivi des anomalies
- Choisissez des Outils que Vous pouvez Personnaliser en fonction de votre Méthode
- Rassembler le tout
- Simplifiez V &V Avec Helix ALM
- V &V: Glossaire des termes
- Acronymes communs de Validation de la conception
Validation de la conception vs Vérification de la conception : Quelle est la différence ?
Quelle est la différence entre la validation et la vérification? En termes simples, la validation de la conception détermine si vous construisez le bon produit. L’appareil fonctionne-t-il comme prévu pour les utilisateurs finaux? La vérification de la conception détermine si vous construisez correctement le produit. Les sorties de conception correspondent-elles aux entrées de conception ?
C’est la différence simple, comme le montre clairement le graphique ci-dessous.
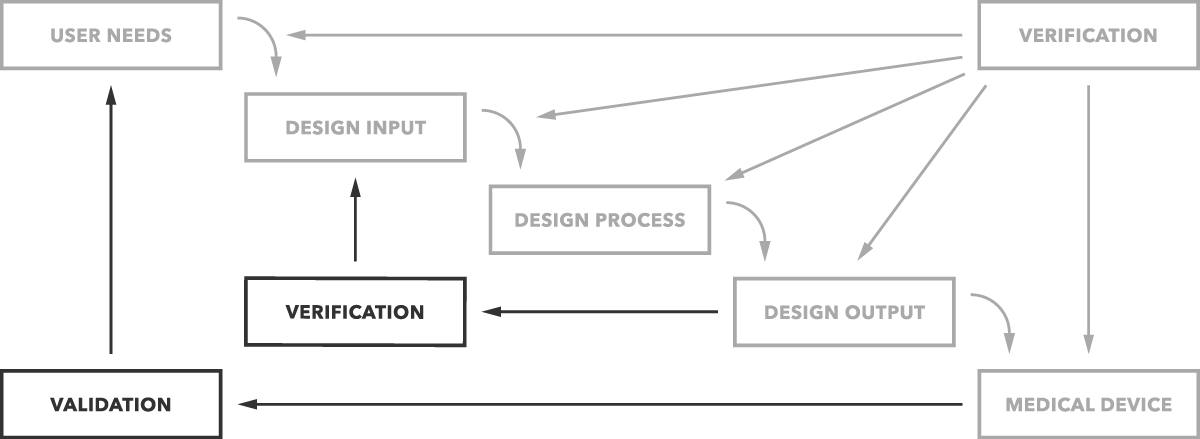
Mais vous voulez plus de détails et d’exemples, bien sûr. Nous commencerons par la validation.
Qu’Est-Ce Que La Validation De Conception Exactement ?
La validation de conception est un processus de test par lequel vous prouvez (« validez ») que le périphérique que vous avez construit fonctionne pour l’utilisateur final comme prévu.
Un mot officiel de la FDA (21 CFR 820.3) indique que la validation de la conception consiste à « établir par des preuves objectives que les spécifications des appareils sont conformes aux besoins de l’utilisateur et à l’utilisation prévue. »
Exemple de validation de conception
Imaginons que nous construisons un ventilateur qui maintient un patient à respirer et que l’utilisateur souhaite qu’il fonctionne pendant le transport du patient.
Nous devons d’abord définir les besoins de nos utilisateurs. L’utilisateur souhaite déplacer les patients lorsqu’ils sont sous le ventilateur. Mais qu’essaient-ils réellement de faire? Le « transport » peut inclure le déplacement du patient à l’intérieur de l’hôpital. Ou peut inclure le transport par ambulance ou par avion. Un besoin de l’utilisateur, par exemple, peut ressembler à ce qui suit.
Besoin de l’utilisateur
| UsNe-0001 | Le ventilateur peut être utilisé pendant le transport hospitalier des patients. |
Ce besoin de l’utilisateur sera divisé en exigences du produit et spécifications de conception afin de concevoir et de construire le produit. (Nous les examinerons dans un instant sous vérification de la conception.)
Avant cela, examinons nos besoins des utilisateurs et voyons quels cas de test de validation de conception pourraient être nécessaires. Les tests de validation de nos besoins des utilisateurs pourraient ressembler à ceci.
| Besoin de l’utilisateur | Validation Test |
||
|---|---|---|---|
| UsNe -0001 | Le ventilateur peut être utilisé lors du transport à l’hôpital des patients. | TCase-0001 | Suite de tests de validation: Testez que le ventilateur peut être facilement roulé par 15 membres du personnel de transport hospitalier. |
| TCase-0002 | Suite de tests de validation: Vérifier que le ventilateur fonctionne conformément à ses spécifications tout en étant roulé dans les couloirs, au-dessus des bourrages de portes et au-dessus des seuils d’ascenseur. | ||
| TCase-0003 | Suite de tests de validation: Testez que le ventilateur fonctionne conformément à ses spécifications lors de la transition entre l’alimentation CA et le fonctionnement sur batterie. | ||
Les tests de validation comprendraient des cas de test, des suites de tests ou même des essais cliniques conçus pour prouver que le produit, tel qu’il est construit, fonctionne selon les attentes de l’utilisateur dans les conditions où il a l’intention de l’utiliser. Étant donné que ces essais doivent être effectués sur des unités de production ou des unités équivalentes à la production, les essais de validation de la conception sont souvent les derniers essais effectués.
Fondamentalement, lors de la validation de la conception, nous devons démontrer que le produit répond aux besoins de l’utilisateur.
D’ailleurs, le tableau ci-dessus montre également la traçabilité entre les besoins des utilisateurs et les cas de test. Cette matrice de traces fournit une partie de la preuve V&V requise par la FDA.
Qu’est-ce que la Vérification de conception pour la FDA?
La vérification de conception est l’endroit où vous testez ( » vérifiez ») que vos sorties de conception correspondent à vos entrées de conception.
Encore une fois, selon la FDA, la vérification de la conception est « la confirmation par un examen et la fourniture de preuves objectives que les exigences spécifiées ont été remplies. »
Gardez à l’esprit que même si cela impliquera des tests, il existe d’autres activités de vérification acceptables.
Ils peuvent inclure des tests, des inspections et des analyses (pour en savoir plus, consultez les Directives de contrôle de la conception de la FDA).
Exemple de vérification de la conception
Revenons à notre exemple de ventilateur. Nous avons identifié les besoins de nos utilisateurs; identifions maintenant ce que l’appareil doit faire et comment il doit le faire.
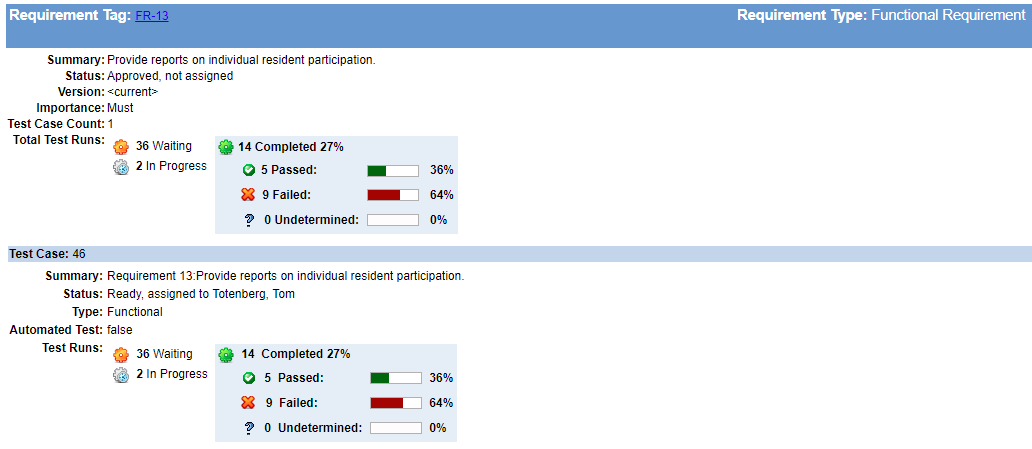
Pour y parvenir, nous devons définir les exigences spécifiques des produits. Par exemple :
- Quelle est la charge maximale pour un patient? (De quelle quantité d’air le ventilateur doit-il bouger?)
- Combien de temps la batterie doit-elle durer? (Combien de temps dure le transport?)
- Quelles conditions rencontreront-ils pendant le transport ? (Les portes se bloquent? Des ascenseurs ?)
- Y a-t-il des normes réglementaires qui doivent être respectées? (Normes de sécurité?)
« Des exigences claires, complètes, sans ambiguïté et testables sont un élément clé d’un projet de développement réussi. Des exigences inadéquates entraînent une perte de temps, des erreurs de conception, des retouches étendues et des produits fragiles ou sujets aux erreurs. »- Megan Martin, V&V Consultant
C’est la partie « quoi » de la définition des caractéristiques de l’appareil. Que devra faire exactement l’appareil? Les exigences du produit (souvent incluses dans un document d’exigences du produit) pour nos besoins d’utilisateur peuvent ressembler à celles ci-dessous.
Exigences du produit
|
PrRq-0001 |
Le ventilateur doit avoir un réglage maximal des respirations à volume contrôlé de 2 litres à 20 respirations par minute. |
|
PrRq-0002 |
Le ventilateur doit fonctionner sur batterie aux réglages maximum pendant au moins 90 minutes. |
|
PrRq-0003 |
Le ventilateur doit pouvoir être monté sur un support roulant. |
|
PrRq-0004 |
Le ventilateur et le support doivent pouvoir franchir les seuils typiques de la porte et de l’ascenseur de l’hôpital. |
Enfin, nous avons besoin de spécifications de conception. « Nous avons déjà défini ce que nous allons réaliser, et maintenant nous devons définir comment nous allons le faire », explique Megan. Cela peut être accompli de diverses manières, y compris des spécifications écrites, des dessins électriques ou mécaniques, des spécifications d’achat de composants ou d’autres méthodes.
Par exemple, les spécifications de conception et les dessins peuvent montrer ce qui suit.
Spécifications de conception
|
DSpec-0001 |
Une turbine qui peut générer jusqu’à 40 litres d’air par minute. |
|
DSpec-0002 |
Une batterie lithium-ion d’une puissance nominale d’au moins 100 Ampères-heures. |
|
DSpec-0003 |
Le support pour le support roulant utilise une pince à levier en acier d’une capacité nominale de 22 lb. |
|
DSpec-0004 |
La base du support est de 22″ de large avec 5 roues. |
|
DSpec-0005 |
Les roues de support ont un diamètre de 4″. |
La vérification de la conception fournit la preuve (résultats des tests) que les sorties de conception (produit réel) répondent aux entrées de conception (exigences du produit et spécifications de conception). Selon l’élément vérifié, un scénario de test ou une suite de tests serait exécuté, ou une inspection ou une analyse serait effectuée pour fournir les preuves requises.
Les tableaux ci-dessous illustrent à quoi cela pourrait ressembler. Ils montrent également la traçabilité attendue par la FDA.
| Exigence du produit | Test de vérification | ||
|---|---|---|---|
| PrRq-0001 | Le ventilateur doit avoir un réglage maximal de volume de 2 litres – respirations contrôlées à 20 respirations par minute. | TCase-0004 | Cas de test: Vérifiez les paramètres de respiration maximum ou les combinaisons de paramètres de respiration. |
| PrRq-0002 | Le ventilateur doit fonctionner sur batterie à des réglages maximum pendant au moins 90 minutes. | TCase-0005 | Suite de tests: Vérifiez le temps d’exécution sur les paramètres maximaux avec une nouvelle batterie complètement chargée. |
| TCase-0006 | Suite de tests: Vérifiez le temps d’exécution sur les paramètres maximaux avec une batterie qui a subi 50 cycles de charge. | ||
| PrRq-0003 | Le ventilateur doit pouvoir être monté sur un support roulant. | TCase-0007 | Essai de démonstration : Démontrer que le ventilateur peut être fixé et détaché du support roulant. |
| PrRq-0004 | Le ventilateur et le support doivent pouvoir franchir les seuils typiques de la porte et de l’ascenseur de l’hôpital. | TCase-0008 | Test externe: Test exécuté par un service de test pour vérifier que le ventilateur et le support peuvent dépasser un seuil sans basculement selon la norme électrique médicale CEI 60601-1. |
La vérification des exigences du produit, comme ci-dessus, montre que le produit fait ce que nous avons dit qu’il ferait.
La vérification des spécifications de conception, que nous montrerons ensuite, montre que le produit le fait comme nous l’avions dit.
| Spécification de conception | Test de vérification | ||
|---|---|---|---|
| DSpec-0001 | Une turbine pouvant générer 40 litres d’air par minute. | TCase-0009 | Suite de tests: Vérifiez la génération d’air par turbine à 40 lpm sur une alimentation en courant alternatif ou sur batterie. |
| DSpec-0002 | Une batterie lithium-ion de 100 Ampères-Heures. | TCase-0010 | Test d’inspection: Vérifiez que les spécifications d’achat de la batterie indiquent que le type est au lithium-ion. |
| TCase-0011 | Test d’analyse: Collecter les données de test et effectuer une analyse des données pour démontrer les performances de la batterie pendant toute la durée de vie de la batterie, elle atteindra ou dépassera 100 Ampères-heures. | ||
| DSpec-0003 | Le support pour le support roulant utilise une pince à levier en acier d’une capacité nominale de 22 lb. | TCase-0012 | Test d’inspection: Vérifiez que la spécification de la pièce concerne une pince à levier en acier de 22 lb ou plus. |
| DSpec-0004 | La base du support est de 22″ de large avec 5 roues. |
TCase-0013 |
Cas de test: Mesurer le diamètre de la base; compter les roues; mesurer le diamètre des roues |
| DSpec-0005 | Les roues de support ont un diamètre de 4″. | ||
Essentiellement, dans la vérification de la conception, nous devons démontrer que le produit que nous avons construit est le produit que nous avons dit que nous construirions.
Lorsqu’ils sont rassemblés dans un rapport V&V, la combinaison des résultats des tests de vérification et de validation, ainsi que la traçabilité des besoins des utilisateurs, des exigences du produit et des spécifications de conception, fournit une partie des preuves requises par la FDA lors de la soumission d’un dispositif médical pour autorisation.
Résumé de la validation par rapport à la vérification
Voici un bref résumé, bien que légèrement simplifié, des principales différences.
|
Design Verification |
Design Validation |
|
Design output is as expected. |
Final design meets user’s needs. |
|
System, subsystem and unit testing. |
System testing. |
|
During development. |
After development. |
|
Test individual module or completed system under any conditions. |
Test conditions per user needs. |
|
Comprend les inspections, l’analyse et les tests du système. |
Comprend les essais d’unités équivalentes à la production en conditions réelles d’utilisation. |
|
Comprend les rapports des tests effectués, les résultats des tests et la traçabilité. Les rapports sont examinés, approuvés et signés. |
Comprend un rapport final, avec les résultats des tests et la traçabilité, prêt pour l’examen réglementaire. Les rapports sont examinés, approuvés et signés. |
Bases du processus de validation de la conception
Le processus de validation de la conception consistera en grande partie à tester le périphérique. Vous pouvez procéder de plusieurs manières, selon les circonstances. Les activités peuvent inclure:
- La comparaison avec un équipement similaire fonctionnant à des fins similaires.
- Simulation de fonctionnalités par modélisation mathématique.
- Tester la conception finale pour prouver que le système fonctionne comme défini dans les besoins de l’utilisateur.
Le plan de test, les cas de test, les enregistrements d’exécution des tests et les résultats des tests doivent être documentés et conservés dans le cadre des enregistrements de conception. La validation, dans son intégralité, n’est pas le résultat d’une seule activité, mais la collecte des résultats de toutes les activités de validation.
Principes de base du processus de vérification de la conception
La vérification peut être réduite à un simple processus en cinq étapes.
Identifier et préparer
Identifier la meilleure approche pour effectuer la vérification. Définissez ce que vous mesurerez et comment vous le mesurerez. Vous voudrez également prendre en compte les ressources, la main-d’œuvre et les outils nécessaires pour une vérification réussie.
Planification
La planification de la vérification se fait tout au long du cycle de vie du projet. Vous développerez le plan de test, qui capture les étapes critiques. Le plan doit être mis à jour chaque fois que des modifications sont apportées aux intrants de conception.
Développement
Le développement de produits commence! Il est réalisé en utilisant la méthodologie de choix (Scrum, Waterfall, hybrid, etc.). Cette partie du processus comprend également la rédaction, la conduite d’essai et l’approbation des cas de test qui seront utilisés pour la vérification.
Exécution
Les procédures de test sont exécutées comme prévu. Tous les résultats non valides sont documentés et examinés, et acceptés ou enregistrés comme des défauts. Les défauts du produit sont résolus et libérés, et des tests de régression sont effectués. Une matrice de traçabilité est créée pour vérifier que les entrées de conception identifiées dans le plan d’essai de vérification ont été testées et réussies.
Reporting
Le reporting est effectué à la fin de chaque phase de vérification. Les rapports détaillés comprennent les rapports de gestion de la configuration et de publication, les résultats des tests par type de test ou version de produit et les problèmes détectés lors de l’activité de vérification. Un rapport de traçabilité de la vérification de la conception montre les résultats des tests et la couverture des exigences. Enfin, les examens sont terminés et approuvés après chaque activité de vérification de la conception.
6 Conseils pour une meilleure validation &Vérification
Voici des conseils pour vous assurer de tirer le meilleur parti de vos activités de validation &.
Planifiez à l’avance (Et Testez Tôt)
Ayez un plan solide à l’avance et bouclez tout le monde. Inclure des ingénieurs de test dès le début de la planification du développement pour s’assurer que les exigences et la conception sont claires, complètes et testables. Selon Megan, « Le développement précoce de méthodes de test peut éclairer les problèmes technologiques avant qu’ils ne deviennent des obstacles majeurs. »Le développement de tests précoces peut également fournir des outils de test. Ceux-ci peuvent ensuite être utilisés pour accélérer le processus de développement du produit et fournir des preuves de test lors des tests formels.
Utiliser la nomenclature partagée
Il est essentiel de mettre votre équipe sur la même longueur d’onde pour réussir la validation de la conception&vérification. Une partie de la mise sur la même page signifie utiliser une terminologie partagée. L’utilisation des mêmes termes élimine la confusion pour les membres de l’équipe (pas seulement les nouveaux membres — les vétérans aussi). Consultez le glossaire des termes et des acronymes courants ci-dessous pour vous aider à développer votre base terminologique.
Utilisez des Outils Avec une Traçabilité de bout en bout
Dans sa plus simple expression, la traçabilité peut être obtenue avec des documents Word et des feuilles de calcul, mais ils génèrent tellement de travail manuel (et sont si sujets aux erreurs) que vous souhaiterez commencer avec un outil dédié.
« Une matrice de trace précise est précieuse lors de l’analyse de régression pour déterminer ce qui doit être testé à nouveau après un changement de produit ou une correction de bogue. »- Megan Martin, V &V Consultant
L’utilisation d’un outil doté d’une forte capacité de suivi des exigences, des tests et des résultats vous aidera à identifier les trous dans la couverture et à donner des alertes précoces sur les zones fragiles ou non testées du produit.
Obtenez une traçabilité de bout en bout maintenant
Construisez Votre Matrice de traces Au fur et à mesure
« Il peut être tentant de la remettre à plus tard, mais n’attendez pas pour construire votre matrice de traces! » dit Megan. Construire votre traçabilité au fur et à mesure empêchera les trous de se développer inaperçus. Peu de choses sont plus difficiles à récupérer que de découvrir que vous avez manqué des exigences critiques, des fonctionnalités d’atténuation des risques ou des tests essentiels au moment où vous pensez que votre travail de développement est terminé.
Il faut beaucoup moins d’efforts de maintenance pour maintenir la traçabilité à mesure que vos exigences, vos conceptions et vos tests évoluent que pour colmater des trous critiques dans la conception et le développement à la 11e heure. Cet effort peut également vous aider à identifier la quantité de travail restant, où vous devrez peut-être ajouter du personnel de développement ou de test, ou quand vous devriez réévaluer les calendriers de livraison.
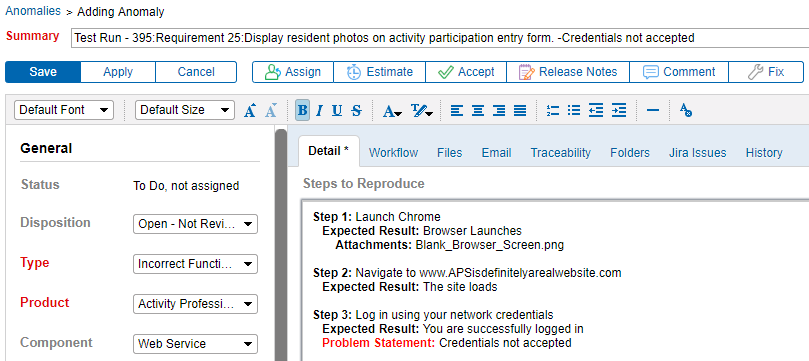
Intégrer la traçabilité des exigences &Tester avec suivi des anomalies
Pouvoir lier les anomalies directement à une exigence améliore la communication entre les testeurs et les développeurs. C’est extrêmement utile. La génération d’anomalies directement à partir d’une défaillance du protocole de test signifie que plus de détails sur le problème sont capturés. En conséquence, les problèmes peuvent être plus facilement documentés, reproduits, corrigés et retestés.
Choisissez des Outils que Vous pouvez Personnaliser en fonction de votre Méthode
» Quel que soit le modèle de développement que vous avez sélectionné — Agile, itératif, cascade modifiée — vous souhaitez choisir V &V outils qui vous servent en vous adaptant à votre processus, plutôt que de vous forcer à adapter votre processus pour servir l’outil », conseille Megan.
Les outils de développement de dispositifs médicaux que vous choisissez doivent améliorer la précision et l’efficacité du travail de votre équipe et ne pas ajouter de surcharge inutile à leurs tâches quotidiennes. Un bon outil fournit des garde-corps pour s’assurer que les choses importantes sont toujours faites. Il donne à votre équipe la flexibilité nécessaire pour produire des vues et des rapports ad hoc afin de mieux utiliser (et explorer) les données que vous avez capturées. Il fournit V&V capture de données et rapports ciblés pour rendre la production de rapports simple et reproductible.
Prenez le temps de définir comment vous souhaitez que les outils soutiennent votre équipe avant de choisir. Configurez ensuite vos outils en fonction des besoins de votre équipe.
Rassembler le tout
La validation et la vérification de la conception sont des composants essentiels du développement réussi du périphérique. Avec une compréhension partagée au sein de l’équipe, ainsi que les bons outils, vous disposez d’un cadre solide pour commercialiser votre appareil.
REGARDEZ TOUTE LA DÉMO MAINTENANT >>
Simplifiez V &V Avec Helix ALM
Découvrez comment Helix ALM peut accélérer le développement de dispositifs médicaux.
Explorez Helix ALM
*Encore une fois, grâce à l’experte de V& Megan Martin qui a fourni des informations inestimables à ce blog!
V &V: Glossaire des termes
Résultat réel – Ce qu’un système fait réellement lorsqu’une action est effectuée.
Anomalie – Lorsqu’un système n’agit pas comme prévu. Par exemple, un bogue, une erreur ou un échec de test.
Livrable – Un objet obligatoire produit à la suite de l’exécution du projet, généralement des documents dans les efforts de validation.
Déviation – Lorsqu’un processus ou une procédure ne peut pas être exécuté comme défini et qu’une méthode ou un matériau alternatif est utilisé.
Résultat attendu – Ce qu’un système doit faire lorsqu’une action est effectuée.
Test d’intégration – Test effectué à l’aide de deux sous-systèmes ou plus pour vérifier l’interaction et les interdépendances des sous-systèmes.
Protocole – Une collection de cas de test utilisés pour documenter les tests du système.
Qualification – Protocole de test indiquant qu’un système répond à un ensemble défini d’exigences.
Assurance qualité – Membres de l’équipe chargés d’assurer la qualité du produit ou l’intégrité du processus.
Exigence – Quelque chose qu’un système doit être capable de faire.
Validation rétrospective – Validation d’un système qui existe déjà.
Spécification – Document décrivant les exigences d’un système ou d’un composant.
Test de sous-système – Test effectué sur un sous-système ou un groupe de composants principaux.
Système – La chose en cours de validation.
Propriétaire du système – La personne qui est en fin de compte responsable d’un système.
Test du système – Test effectué en utilisant le système dans son ensemble.
Cas de test – Une procédure documentée, utilisée pour tester qu’un système répond à une exigence ou à une collection d’exigences.
Plan d’essai – Une méthodologie d’essai établie pour s’assurer qu’un système répond aux exigences.
Étape de test – Une ligne individuelle d’un cas de test. Il devrait inclure des instructions, le résultat attendu et le résultat réel.
Traçabilité – La capacité de s’assurer que les exigences énoncées dans les spécifications ont été testées. Souvent capturé dans une matrice de traçabilité des exigences.
Test unitaire – Test effectué sur une unité logicielle ou matérielle ou un module de bas niveau.
Validation – Établir par des preuves objectives que les spécifications de l’appareil sont conformes aux besoins de l’utilisateur et à l’utilisation prévue.
Package de validation – Une collection de documents produits lors d’un projet de validation.
Vérification – confirmation par examen et fourniture de preuves objectives que les exigences spécifiées ont été remplies.
V&V Plan – Un plan définissant les exigences à vérifier et à valider, ainsi que la main-d’œuvre, les personnes responsables, les outils, les méthodes, les ressources et le calendrier de l’effort V&V.
Acronymes communs de Validation de la conception
CC– Contrôle des changements
CCB– Tableau de contrôle des changements (un groupe de personnes qui contrôlent les modifications apportées et quand)
DS–Spécification de conception
FAT– Essais d’acceptation en usine
FS– Spécification fonctionnelle
FRS – Spécification des exigences fonctionnelles (Voir Spécification fonctionnelle)
GCP – Bonnes pratiques cliniques (Directives de qualité pour les opérations cliniques)
/p>
BPL – Bonnes pratiques de laboratoire (directives de qualité pour les opérations des laboratoires pharmaceutiques)
BPF – Bonne fabrication Pratique (directives de qualité pour la fabrication de dispositifs ou de produits pharmaceutiques)
RTM – Matrice de Traçabilité des exigences
SAD– Document d’Architecture Logicielle ou Document d’Architecture Système
Test d’Acceptation sur site SAT
SCCB – Tableau de Contrôle des Modifications logicielles (identique à CCB, mais pour les logiciels)
SDD–Document de Conception Détaillée du Logiciel
SDS – Spécification de Conception logicielle
Spécification Spec
SRS – Exigences logicielles Spécification
Matrice de traçabilité TM
UAT– Tests d’acceptation par l’utilisateur
URS– Exigences de l’utilisateur Specification
UUT – Unit Under Test
VMP – Validation Master Plan
VP – Validation Plan
V&V – Verification and Validation