Procédures d’élingue
Les opérations d’élingue sont parmi les plus anciennes procédures anti-incontinence effectuées. Ils ont évolué à partir d’une tentative de soutenir l’urètre et de recréer ou d’augmenter le tonus du sphincter urétral perdu à la suite d’une blessure ou d’une atrophie. Ces procédures sont conçues pour rétrécir l’urètre, fournir un soutien urétral, augmenter la pression de fermeture urétrale (UCP) par compression externe et restaurer l’angle urétrovésical postérieur.7 Le concept selon lequel les procédures d’élingage augmentent la PCU a récemment été remis en question parce que certaines études de suivi n’ont pas montré d’augmentation significative.8,9 Bien qu’il n’y ait pas de patient typique lorsqu’il s’agit de traiter l’incontinence urinaire, de nombreux urogynécologues réservent des procédures de fronde aux patientsqui ont déjà eu des procédures anti-incontinence infructueuses. Ces patients sont souvent gravement incontinents et présentent peu ou pas de mobilité urétrale lors de l’augmentation de la pression intra-abdominale. Leur PCU est généralement faible (< 20 cm H2O), et ils ont de faibles pressions de point de fuite de Valsalva (< 60 cmH2O). Ce sont les critères diagnostiques généralement acceptés pour les intrinsèquesdéficience de phincter.
La procédure d’élingue moderne a évolué à partir d’une opération décrite par Giordanoin 1907, au cours de laquelle des lambeaux musculaires gracilis ont été transplantés près de l’urètre. En 1917, les chirurgiens Goebell, Frankenheim et Stoeckel ont développéune procédure de fronde utilisant le muscle pyramidal avec fascia droit attaché. Après que les ventres musculaires ont été disséqués libres au niveau de la symptolyse, les extrémités ont été passées derrière l’os pubien et suturées en dessous de l’urètre. Le cou vésical était également plicé. Les années 1930 ont vu la diminution des élingues musculofasciales et l’avènement des élingues composées uniquement de fascia. En 1942, Aldridge a décrit une opération qui ressembleune variante de la procédure de fronde encore pratiquée aujourd’hui. Il a disséqué des bandes bilatérales de fascia rectal de la face antérieure du muscle, laissant les parties médiales attachées au muscle. Les bandes de fascia ont ensuite été creusées dans le muscle, passées derrière la symptolyse et suturées sous l’urètre. Les années suivantes ont apporté l’utilisation de matériaux synthétiques pour les élingues et l’utilisation de ponts de suture et d’élingues de patch.10 Les élingues actuelles sont généralement composées de fascia, soit de tissu donneur cadavérique, soit de tissu prélevé sur la patiente elle-même au moment de l’opération.
Les taux de guérison avec les procédures de fronde sont rapportés à 70% à 95%.11,12 Les résultats sont similaires quel que soit le type de matériau d’élingue utilisé. La variabilité découle de différences dans la technique, la définition de la guérison et la durée du suivi. Bien que les rapports sur les taux de guérison soient abondants, la documentation des complications précoces et tardives est médiocre. En outre, aux risques d’hémorragie, d’infection et de lésion des organes locaux, undoit considérer l’effet de la procédure sur la miction. Il y a un risque de 2% à 30% de dysfonctionnement ou de rétention d’urine sévère.13 Cette estimation est basée principalement sur l’observation et nécessite une étude plus approfondie. L’instabilité du détrusor et divers symptômes irritatifs de la vessie tels que la fréquence et l’urgence surviennent chez 2% à 50% des patients.14 Malheureusement, il est difficile de prédire quels patients auront ces complications. Ces symptômes diminuent souvent avec le temps et peuventêtre traité pharmacologiquement. Les complications moins courantes comprennent l’érosionde la matière de l’élingue (plus fréquente avec les élingues synthétiques), la formation de fistules ou de voies sinusales, une lésion nerveuse ou un piégeage et une abcès. Comme mentionné précédemment, en raison du taux perçu de complications potentielles plus élevé, de nombreux chirurgiens pelviens continuent de pratiquer une urétropexie rétropubique en tant que chirurgie anti-incontinence primaire.
Opérations rétropubiques
Les deux opérations décrites dans cette section ont pour objectif commun l’identification de tissus périurétraux forts près du col de la vésicule et la suture de ces tissus à une structure de soutien attachée au pubis. Cela sert à ramener le col de la vessie à un emplacement intra-abdominal de sorte qu’il voit les mêmes pressions transmurales que la vésicule. Il a été démontré que la pression de fermeture de l’urètre augmentait et diminuait après ces procédures et qu’elle ne jouait donc pas un rôle dans leur mécanisme d’obtention de la continence.15,16
MARSHALL-MARCHETTI-KRANTZ
En 1949, Marshall a rapporté l’observation empirique selon laquelle la suture des tissus périurétraux à l’os pubien soulageait l’incontinence de stress urinaire après avoir examiné un patient souffrant d’incontinence iatrogène après résection du cou vésical.17 La description originale appelait la suture chromique numéro 1, mais les procédures MMK et Burch sont maintenant généralement effectuées avec des sutures permanentes. L’accès à l’espace rétropubique est obtenu comme décrit. Le cou de la vésicule biliaire est identifié en plaçant la main non dominante dans le vagin et en palpant le bulbe Foley avec l’index et le majeur. Lors de l’élévation des doigts vaginaux, un dissecteur Kittner est utilisé pour placer une contre-traction sur le tissu adipeux recouvrant la fascia périurétrale (Fig. 2A encart). Un mouvement de balayage doux nettoie facilement la graisse, révélant le fascia blanc ci-dessous. Cette dissection permet au chirurgien de prendre de bonnes piqûres de tissus et favorise l’adhérence du tissu périurétral à l’arrière de la symphyse. L’élévation du doigt vaginal permet à l’opérateur de placer une morsure de tissu en huit, pleine épaisseur (excluant l’épithélium vaginal si possible) (voir l’ensemble de la Fig. 2B). Une seule suture est placée des deux côtés de la jonction urétrovésiquede cette manière. Chaque suture est ensuite fixée au périoste ou au fibrocartilage de l’os pubien de telle sorte que le col vésical soit à peine mis en contact avec la symphyse pubienne (Fig. 3). Les lésions de la vessie et des uretères sont exclues par cystoscopie, suprapubictélescopie ou cystotomie intentionnelle. Parce que l’efficacité postopératoire est imprévisible, un cathéter suprapubique est la méthode préférée de drainage de la vessie.
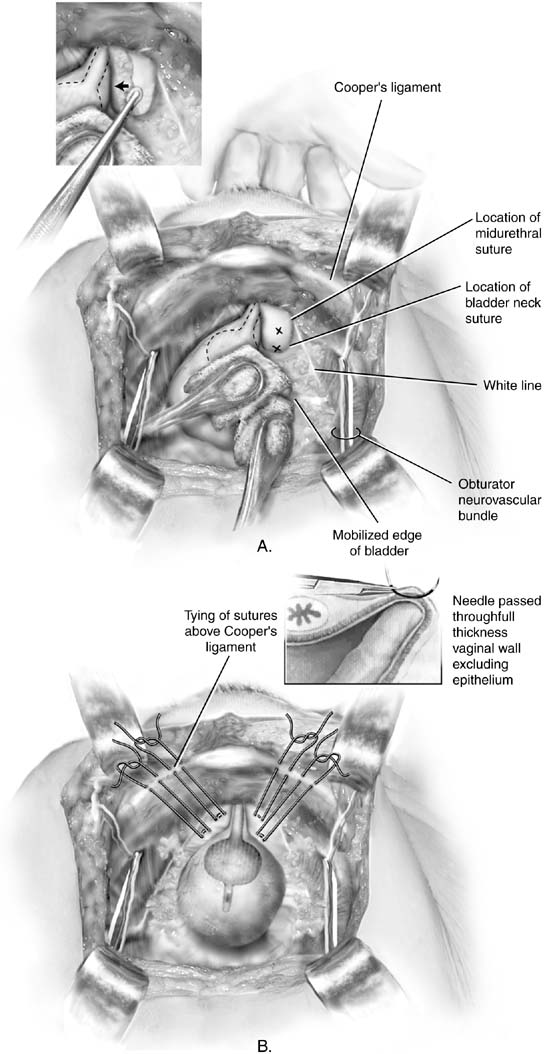 Fig. 2. A. Burch colposuspension. La vessie est doucement mobilisée à l’opposéecôté à l’aide de bâtons d’éponge. La paroi vaginale antérieure est surélevée par le petit doigt de la main non dominante du chirurgien. La position des sutures doit être d’au moins 2 cm de côté de l’urètre proximal et du col de la vessie. Xs marque le placement idéal des colposuspensionsutures de Burch. Encart: La paroi vaginale antérieure du côté droit est soulevée par un doigt vaginal. Un dissecteur Kittner est passé sur le dessus du doigt, mobilisant la graisse médialement. B. Burch colposuspension. Les sutures ont été placées de manière appropriée de chaque côté de l’urètre proximal et du col de la vessie. Figure-huit morssont pris par le vagin. Des sutures à double bras sont utiliséesde sorte que l’extrémité de chaque suture puisse être soulevée à travers le ligament du coopérateur ipsilatéral, permettant ainsi aux sutures d’être attachées au-dessus du ligament. Encart: Détail de la suture placée sur le doigt vaginal du chirurgien. La suture doit inclure une épaisseur complète mur vaginal, à l’exclusion de l’épithélium. (MS Baggish, Karram MM,: Atlasof Anatomie Pelvienne et Chirurgie gynécologique. NewYork, Harcourt, 2001.)
Fig. 2. A. Burch colposuspension. La vessie est doucement mobilisée à l’opposéecôté à l’aide de bâtons d’éponge. La paroi vaginale antérieure est surélevée par le petit doigt de la main non dominante du chirurgien. La position des sutures doit être d’au moins 2 cm de côté de l’urètre proximal et du col de la vessie. Xs marque le placement idéal des colposuspensionsutures de Burch. Encart: La paroi vaginale antérieure du côté droit est soulevée par un doigt vaginal. Un dissecteur Kittner est passé sur le dessus du doigt, mobilisant la graisse médialement. B. Burch colposuspension. Les sutures ont été placées de manière appropriée de chaque côté de l’urètre proximal et du col de la vessie. Figure-huit morssont pris par le vagin. Des sutures à double bras sont utiliséesde sorte que l’extrémité de chaque suture puisse être soulevée à travers le ligament du coopérateur ipsilatéral, permettant ainsi aux sutures d’être attachées au-dessus du ligament. Encart: Détail de la suture placée sur le doigt vaginal du chirurgien. La suture doit inclure une épaisseur complète mur vaginal, à l’exclusion de l’épithélium. (MS Baggish, Karram MM,: Atlasof Anatomie Pelvienne et Chirurgie gynécologique. NewYork, Harcourt, 2001.)
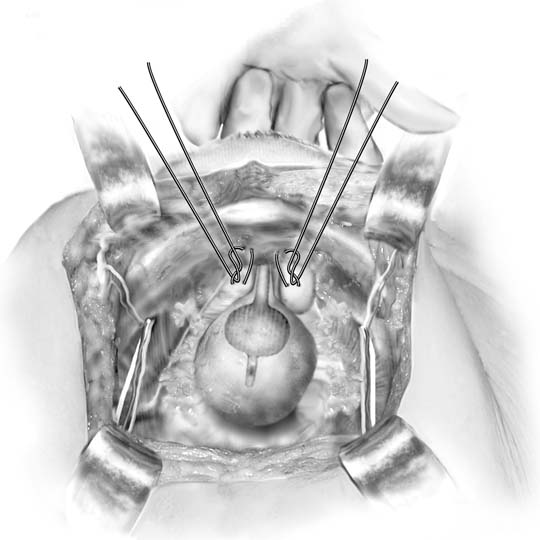 Fig. 3. Procédure Marshall-Marchetti-Krantz. Une suture est placébilatéralement au niveau du col de la vessie, puis dans le périoste de la symphyse pubienne. (Baggish MS, Karram MM,: Atlas d’Anatomie Pelvienne et de chirurgie gynécologique. New York, Harcourt, 2001.)
Fig. 3. Procédure Marshall-Marchetti-Krantz. Une suture est placébilatéralement au niveau du col de la vessie, puis dans le périoste de la symphyse pubienne. (Baggish MS, Karram MM,: Atlas d’Anatomie Pelvienne et de chirurgie gynécologique. New York, Harcourt, 2001.)
COLPOSUSPENSION de BURCH
La procédure de Burch a été décrite en 1962 après que l’initiateur de la procédure a été incapable de trouver un périoste adéquat chez un patient âgé qu’il essayait d’effectuer une procédure MMK.18 L’espace rétropubique est entré et préparé comme décrit pour la procédure MMK. Deux sutures permanentes en huit sont placées de part et d’autre du col de la vessie. Les sutures proximales sont placées 2 cm latéralement au col de la vessie et les sutures distales sont placées 2 cm latéralement au tiers proximal de l’urètre (voir Fig. 2 BIS). Les extrémités de chaque suture sont ensuite passées à travers le ligament de Cooper soit à l’aide d’une aiguille de Mayo incurvée, soit à l’aide d’une suture à double bras. Une fois que toutes les sutures sont placées, le chirurgien élève le vagin tandis qu’un assistant attache les sutures avec les nœuds au sommet du ligament de Cooper (voir Fig. 2B). Les sutures distales sont attachées en premier. Une fois terminé, le chirurgien devraitêtre capable de passer facilement deux doigts entre l’os pubien et l’urètre. Les ponts de suture ne sont pas problématiques et sont généralement présents. Une évaluation intravésicale est recommandée pour s’assurer qu’aucune lésion de la vessie ou de l’uretère ne s’est produite.
Des approches laparoscopiques de la procédure de Burch ont également été décrites. Des études rétrospectives et observationnelles suggèrent que les taux de guérison sont similaires aux procédures ouvertes.19 Trois essais prospectifs comparant ces deux techniques ont été publiés. Burtonin 1994 et Su en 1997 ont trouvé l’approche ouverte supérieure (97 % contre 73 % et 96 % contre 80 %, respectivement).20,21 Fatthy et associés ont rapporté des taux de guérison similaires pour la procédure ouverte par rapport à une approche laparoscopique modifiée suivie jusqu’à 18 mois (85% vs. 88%) et ont trouvé moins de morbidité et un séjour à l’hôpital plus court dans le groupe laparoscopique.22 Malheureusement, il est difficile de faire des comparaisons entre les approches ouvertes et laparoscopiques secondaires à une multitude de variations techniques (à l’exception de l’approche réelle) de la procédure traditionnelle.
Les taux de guérison pour les procédures rétropubiques sont similaires, de 65% à 90%, à 1 à 10 ans.23,24 En effet, l’essai prospectif randomisé unique qui a comparé le Burch avec les procédures MMK n’a trouvé aucune différence significative dans le taux de guérison.23 Ces procédures ont résisté à l’épreuve du temps et il existe des données sur le taux de réussite à long terme. Cela est particulièrement vrai pour la procédure de Burch, quiest la plus étudiée des deux opérations. Il semble qu’au fil du temps, le taux de guérison des suspensions rétropubiques diminue régulièrement de 90% à 1 an à environ 70% en 10 ans après l’opération, avant d’atteindre un plateau à 65% à 70% chez les patientsqui ont été suivis plus de 20 ans.24 Les complications des procédures rétropubiques sont similaires aux procédures de fronde avec quelques différences d’incidence. Parce que plus de dissection est nécessaire pour les procédures rétropubiques par rapport aux procédures de fronde, on anticiperait une incidence plus élevée de complications infectieuses et hémorragiques, mais sans s’inquiéter des érosions et de la formation du tractus sinusal. Le risque d’instabilité du détrusor de novo est rapporté de 5% à 27%, mais Alcalay et les associés ont signalé des patients avec un suivi de 10 ans avec une incidence de 14%. Ils ont également signalé un dysfonctionnement vocal dans 22% des cas.25 Une complication unique aux suspensions rétropubiques est la survenue d’une ostéite pubienne, qui survient jusqu’à 2.5% des patients subissant la procédure MMK. Études à long terme de la procédure de burchont montré une incidence significative de la formation de prolapsus. La rectocèle a été notée chez 11% à 25% et l’entérocèle chez 4% à 10% des patients suivis 10 à 20 ans.24
Réparation paravaginale
Une discussion sur la réparation paravaginale est incluse ici car il s’agit d’une procédure arétropubique. Il ne doit pas être considéré comme un anti-incontinenceopération primaire. Le but de cette opération est de réparer un défaut anatomique spécifique: séparation d’un ou des deux côtés du hamac endopelvicfascial qui s’insère normalement au niveau de l’arcus tendineus fasciaepelvis (ligne blanche) au niveau de la paroi latérale pelvienne. Dans le passé, il a été utilisé comme un moyen de traiter l’incontinence de stress.26 Bien qu’il fasse continent à certaines femmes, probablement par élévation du col de la vessie, il ne produit pas de résultat durable. Comme Colombo et les collégiens l’ont montré, la procédure Burch est clairement supérieure pour le traitement de l’incontinence.27 Chez les patients présentant des anomalies paravaginales avec cystocèle résultante associée à une incontinence de stress, une procédure appelée paravaginal plus a été décrite. Dans cette procédure, les défauts paravaginaux sont réparésdans le paragraphe suivant, et les sutures de colposuspension de Burch sont placées comme décrit précédemment (Fig. 4). Pour effectuer la réparation abdominale paravaginale, on accède àl’espace rétropubique comme décrit précédemment. La colonne vertébrale ischiatique etle fascia arcus tendineus attaché doit être identifié. Les défauts paravaginaux sont clairement apparents sous la forme d’une partie détachée du vagin à partir de la ligne blanche (fig. 5A et 5C). À l’aide de la main non dominante, le chirurgien élève le sillon vaginal antérolatéral du côté du défaut. Une morsure en huit de tissu vaginal de pleine épaisseur (à l’exclusion de l’épithélium) est prise avec une suture permanente près de l’apex vaginal, puis fixée à la ligne blanche ou au fascia du muscle obturateur interne de 1 à 2 cm de la colonne vertébrale ischiatique. C’est attaché. Ensuite, en procédant de manière distale, trois ou quatre sutures similaires sont placées de telle sorte que la suture finale soit aussi proche que possible du ramus pubien (voir Fig. 5B).
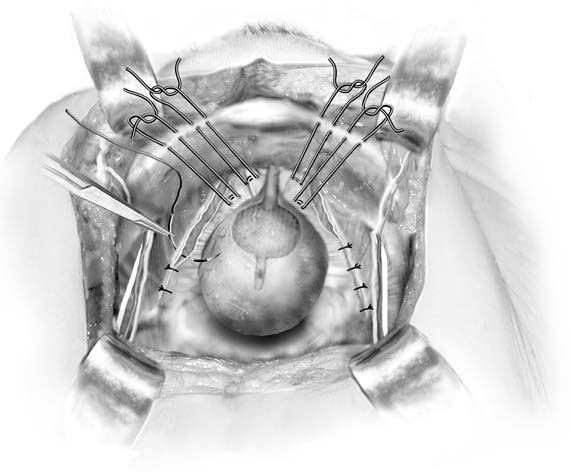 Fig. 4. Paravaginal plus. Chez les patients présentant des défauts paravaginaux et une incontinence urinaire à l’effort, les défauts paravaginaux sont réparés, puis des colposuspensionsutures Burch sont placées. (Baggish MS, Karram MM,: Atlas d’Anatomie Pelvienne et de chirurgie gynécologique. New York, Harcourt, 2001.)
Fig. 4. Paravaginal plus. Chez les patients présentant des défauts paravaginaux et une incontinence urinaire à l’effort, les défauts paravaginaux sont réparés, puis des colposuspensionsutures Burch sont placées. (Baggish MS, Karram MM,: Atlas d’Anatomie Pelvienne et de chirurgie gynécologique. New York, Harcourt, 2001.)
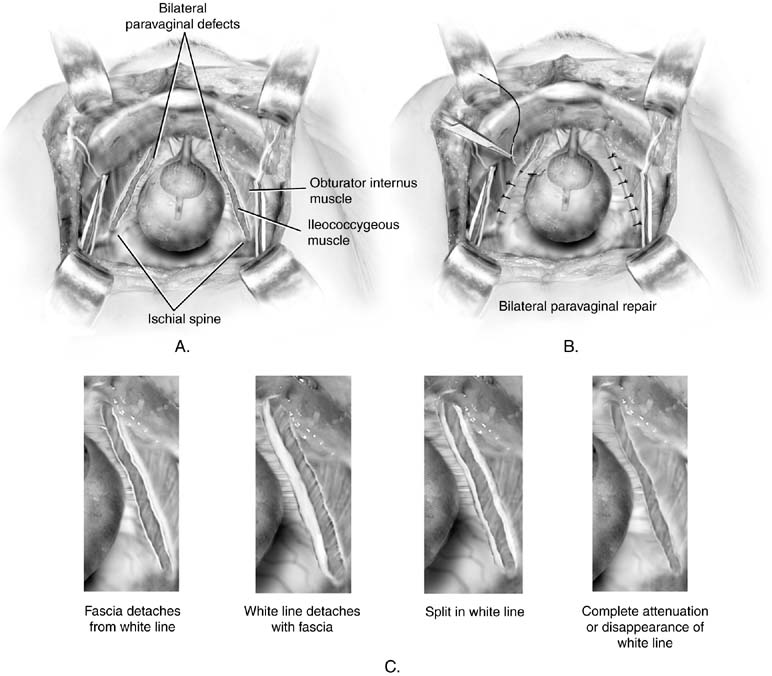 Fig. 5. A. Défaut paravaginal. Les défauts bilatéraux sont illustrés. B. Réparation du défaut paravaginal rétropubique. Les défauts sont réparés en plaçant la première suture juste distale de la colonne vertébrale ischiatique et en travaillant vers la symphyse. C. Défaut paravaginal. Quatre découvertes anatomiques potentielles chez des patients présentant des anomalies vaginales sont illustrées. Tous entraînent une chute du vagin avec son fascia sous-jacent de la paroi latérale pelvienne latérale. (Baggish MS, Karram MM,: Atlas d’Anatomie Pelvienne et de chirurgie gynécologique. New York, Harcourt, 2001.)
Fig. 5. A. Défaut paravaginal. Les défauts bilatéraux sont illustrés. B. Réparation du défaut paravaginal rétropubique. Les défauts sont réparés en plaçant la première suture juste distale de la colonne vertébrale ischiatique et en travaillant vers la symphyse. C. Défaut paravaginal. Quatre découvertes anatomiques potentielles chez des patients présentant des anomalies vaginales sont illustrées. Tous entraînent une chute du vagin avec son fascia sous-jacent de la paroi latérale pelvienne latérale. (Baggish MS, Karram MM,: Atlas d’Anatomie Pelvienne et de chirurgie gynécologique. New York, Harcourt, 2001.)
Sphincter artificiel
L’utilisation d’un sphincter artificiel pour traiter l’incontinence urinaire de stress peut être appropriée dans certains cas de perte d’urine sévère. C’est un appareil implantable qui obstrue l’urètre mais peut être ouvert volontairement, permettant au patient de vider sa vessie. En raison de la difficulté technique rencontrée dans la mise en place d’un tel dispositif et du bassin assez limité de patients appropriés, ce moyen de traitement n’a pas acquis une large acceptation.
Les sphincters urinaires artificiels ont été utilisés pour la première fois en 1972. Plusieurs modifications ont abouti à des dispositifs avancés composés d’un brassard, d’un ballon de régulation de pression et d’une pompe de commande (Fig. 6). Le brassard est placé autour du col de la vessie et le ballonnet estfixé dans l’espace rétropubique. La pompe est placée par voie sous-cutanée dans l’une des grandes lèvres (Fig. 7). Le brassard est normalement à l’état activé, dans lequel il est gonflé, ce qui permet de fermer le col de la vessie. Le ballonnet voit des changementsdans la pression intra-abdominale et régule progressivement la pression appliquée au brassard. Lorsque le patient a besoin d’annuler, elle serrala pompe située dans son labium, qui désactive le brassard. La manchette commence automatiquement à se gonfler, mais prend 3 minutes pour le faire, ce qui permet au patient de se vider.
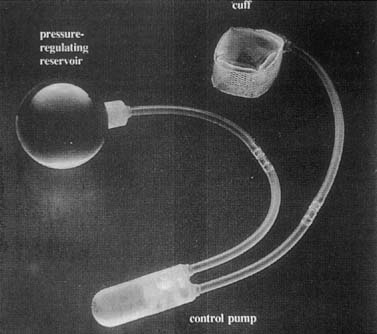 Fig. 6. Sphincter urinaire artificiel AMS 800. Il y a un petit bouton sur le controlpompe pour l’activation et la désactivation de l’appareil. (Walters MD, Karram MM,: Urogynécologie et Chirurgie Pelvienne Reconstructive, 2e éd. Saint-Louis, Mosby, 1999.)
Fig. 6. Sphincter urinaire artificiel AMS 800. Il y a un petit bouton sur le controlpompe pour l’activation et la désactivation de l’appareil. (Walters MD, Karram MM,: Urogynécologie et Chirurgie Pelvienne Reconstructive, 2e éd. Saint-Louis, Mosby, 1999.)
La nature complexe du dispositif rend les patients non motivés et non excentréspour les candidats à cette intervention. Parmi les autres contre-indications, citons la suractivité de la charge qui ne peut pas être contrôlée avec des médicaments ou un biofeedback et un reflux vésico-urétéral de haute qualité. Il y a aussile risque d’infection, d’érosion et de dysfonctionnement de l’appareil. Les taux de succès à court terme avec le sphincter artificiel seraient de 68% à 100%, mais les taux de complications mécaniques sont aussi élevés que 21%.14,28 De plus, les femmes semblent être plus sensibles aux érosions avec cette procédure que les hommes, avec jusqu’à 56% des femmes souffrant de cette complication contre 23% chez les hommes.29 Une série récente de 68femmes qui ont fait l’objet d’un suivi pendant une médiane de 12ans ont signalé un taux global de continence de 81 %, mais seulement 25 (37%) avaient le dispositif d’origine encore en place, 17 % avaient le dispositif remplacé en cas de défaillance mécanique et 46 % avaient le dispositif retiré en cas d’infection due à l’érosion.30