vannak kísérleti módszerek a párosítatlan elektronok kimutatására. Az anyagokban lévő párosítatlan elektronok egyik jellemzője a mágneses mezővel való kölcsönhatás. Ez a kölcsönhatás felhasználható a párosítatlan elektronokat tartalmazó vegyületekről.
elektron paramágneses rezonancia
elektron paramágneses rezonancia (EPR) vagy elektron spin rezonancia (ESR) egy spektroszkópiai módszer. Ez két spin állapot energetikai szétválasztásától függ, amelyek csak mágneses mező jelenlétében léteznek.
az EPR nagyon szorosan kapcsolódik a spin rezonancia spektroszkópia egy másik gyakori típusához, az NMR-hez.
a Spin olyan kvantumtulajdonság, amelynek nincs valódi analógiája, amelynek makroszkopikus szinten lenne értelme számunkra. Tudjuk azonban, hogy a spin mágneses tulajdonságokkal rendelkezik. Az elektronnak két értéke lehet ezekre a mágneses tulajdonságokra. Ezeknek az értékeknek különböző címkéi vannak: néha ” fel “és” le”, néha +1/2 és -1/2. Bármelyik spin-értéknek is van egy elektron, energetikailag nincs különbség.
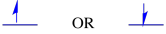
a két lehetséges spin állapot energetikailag azonos-kivéve, ha mágneses mező van jelen. Amint ez a helyzet felmerül, energetikai szétválasztás van a két állapot között.
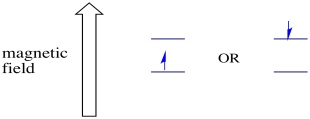
mágneses mező jelenlétében a két spin állapot két különböző energiaszintre oszlik. Az energiaszintek közötti elválasztás mértéke a mágneses mező nagyságától függ. Minél erősebb a mágneses mező, annál nagyobb az elválasztás.
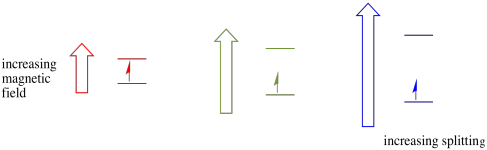
Ez az eset csak párosítatlan pörgetésekre igaz. Ne feledje, hogy a párosítatlan pörgetések kölcsönhatásba lépnek egy mágneses mezővel. Ha minden spin-párosítva van, semmi sem történik. Ez nagyon hasznos, mert módot ad arra, hogy felismerjük azokat a párosítatlan elektronokat.
az egyik spin állapotban lévő elektron még mindig gerjeszthető a másik számára a foton abszorbanciája. Alternatív megoldásként egy magasabb állapotú elektron leeshet az alacsonyabbra, ha fotont bocsát ki.
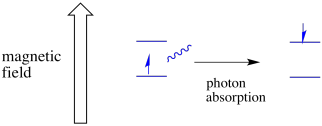
ahhoz, hogy ez megtörténjen, a foton energiájának pontosan meg kell egyeznie az állapotok közötti energiakülönbséggel. Ezt a Goldilocks szabályt rezonancia állapotnak nevezzük. Az egyik energiaszintről a másikra való ugráshoz szolgáltatott energia mennyiségének megfelelőnek kell lennie. Túl kevés energia, és az elektron nem éli túl. Túl sok energia, és az elektron sem fogja túlélni. Csak a megfelelő fotonra vár.
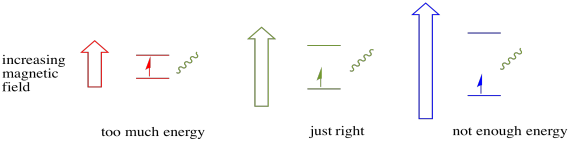
mennyi energiája van egy fotonnak? Emlékezz a Planck-Einstein kapcsolatra. Leírta a foton energiáját:
\(E=h \ nu\)
E a foton energiája, h a Planck-állandó (6,625 x 10-34 Js), és a MHz a foton frekvenciája (úgy néz ki, mint egy római vee, de ez a görög betű, nu).
Alternatív megoldásként a hullámhossz és a frekvencia közötti kapcsolat miatt:
\(E= \frac{hc}{\lambda}\)
az új mennyiségek a C, a fénysebesség (3,0 x 108 m s-1), valamint a foton hullámhossza.
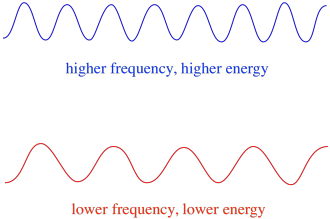
tehát általában a fény különböző hullámhosszai különböző mennyiségű energiát szolgáltatnak. A kék fény, amelynek hullámhossza közel 475 nm, több energiával rendelkezik, mint a vörös fény, hullámhossza közel 700 nm.
az EPR-ben az elektromágneses sugárzás általános tartománya vagy a foton általános fajtája a mikrohullámú sugárzás. Ezeknek a fotonoknak a frekvenciája körülbelül 9 vagy 10 GHz. (A spektroszkópia egy másik típusa, a rotációs spektroszkópia szintén méri a mikrohullámok abszorbanciáját. Általában valamivel magasabb frekvenciájú mikrohullámokat használ. A rotációs spektroszkópia szerkezeti vagy kötési információkat ad a gázfázisban lévő molekulákról.)
a párosítatlan elektron környezetétől függően érzékenyebb vagy kevésbé érzékeny lehet a külső mágneses mező hatására. Ez azt jelenti, hogy a két spin állapot közötti energiafelosztás molekulánként változik. Ennek eredményeként ugyanazon mágneses mezőben lévő különböző molekulák elnyelik a mikrohullámú sugárzás különböző hullámhosszait.
az EPR spektrométert általában úgy tervezték, hogy rögzített hullámhosszú mikrohullámú sugárzást biztosítson a mintához. A mágneses mezőt beállítják, és a műszer méri, hogy milyen térerősség szükséges a fotonok abszorpciójához. Az EPR spektrum az abszorbanciát mutatja a mágneses térerősség függvényében.
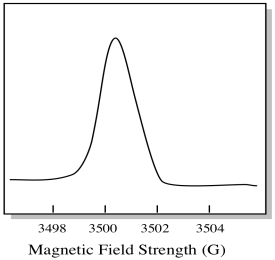
van valami egy kicsit más, hogyan EPR spektrumok általában megjelenik. A fenti ábra származékaként jelenik meg. Ez azért van, mert a műszer méri az abszorbancia változását a mágneses mező megváltoztatásakor; azaz méri d(abszorbancia)/d(mágneses mező). Ez az előző telek lejtése.
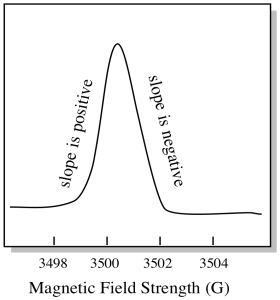
ennek eredményeként egy EPR spektrum valóban így néz ki. Az alapvonal feletti rész az előző diagram pozitív lejtését tükrözi. Az alapvonal alatti rész az előző diagram negatív meredekségét tükrözi.
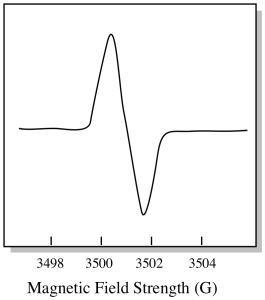
a mágneses térerősség általában nem a csúcshelyzetre jelentett érték. Ehelyett a G-értéknek nevezett valamit jelentik. A G-érték a Zeeman-effektus egyenletéből származik (a mágneses mező hatása a spin energiaszintek közötti felosztásra). Ez az összefüggés a következő:
\(\Delta E = G \beta B\)
ahol az ANNIXE a spinállapotok közötti energiakülönbség, g a g-érték, egy arányossági állandó, amely attól függ, hogy az elektron mennyire érzékeny a mágneses tér hatására, a Bohr magneton (9,274 x 10-24 J T-1) és B az alkalmazott mágneses mező.
Ez azt jelenti, hogy a foton abszorpcióhoz
\(h \ nu = g \ beta B\)
és így
\(g = \frac{ h \nu}{\beta B}\)
ne feledjük, hogy H és a főnévi igenév csak konstansok. Ez azt jelenti, hogy g az alkalmazott mágneses térhez elnyelt foton arányának mértéke. Ez egy szabványosítási lépés. Ha az emberek olyan eszközökkel rendelkeznek, amelyek kissé eltérő hullámhosszúságú mikrohullámú sugárzást használnak, akkor az ugyanazon mintákra mért mágneses mezők nem egyeznének. Ha mindenki csak a hullámhossz és a térerősség arányát méri, akkor mindennek ki kell egyenlítenie. A g-érték egy elektron környezetének reprodukálható mértéke, amelynek laboratóriumonként azonosnak kell lennie.
hasonló gyakorlatot alkalmaznak az NMR spektroszkópiában, hasonló okokból. Amikor kémiai eltolódást jelentünk ppm-ben Hz helyett, korrigáljuk a használt műszer mágneses mezőjének erősségét. Ellenkező esetben ugyanaz a minta Két különböző műszak két különböző eszközön.
kapcsolás az EPR-ben
A kapcsolás olyan jelenség, amelyben a mágneses mezők kölcsönhatásba lépnek egymással. Az EPR-ben a kapcsolás a közeli magok által a megfigyelt elektronra gyakorolt hatás miatt következik be.
például már tudhatja, hogy a hidrogénatom magjának párosítatlan spinje van. Ez az 1H NMR spektroszkópia alapja. Ha ennek a magnak párosítatlan spinje van, akkor társított mágneses mezővel rendelkezik. Mivel a hidrogénmagnak spinértéke lehet +1/2 vagy -1/2, akkor két lehetséges mágneses mező társul hozzá.
egy közeli elektron, egy külső mágneses mezőbe helyezve, most két különböző helyzetben lehet. Vagy a szomszédos proton hozzáad egy kicsit a mágneses mezőhöz, vagy kivon egy kicsit a külső mezőből.
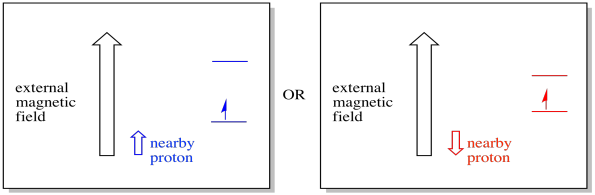
ennek eredményeként az elektron két különböző mezőt tapasztalhat meg. Ne feledje, hogy a spektroszkópiában nem egyetlen molekulával foglalkozunk. Rengeteg molekulával van dolgunk. Néhány molekula egy helyzetben lesz. A molekulák egy része a másik helyzetben lesz. Mindkét helyzetet látni fogjuk. Két különböző mágneses térerősségnél lesz abszorbancia.

ennek eredményeként az EPR spektrum két csúcsot mutat, mint ez:
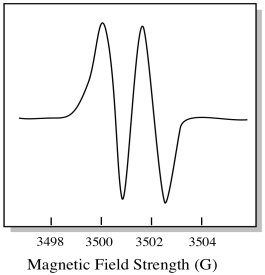
a spektrum ilyen típusú csúcsát kettős abszorbanciának nevezzük. Az EPR-csúcsnak ezt a jellemzőjét sokaságának nevezzük. Hány vonalra oszlik a csúcs? Kettő. Ez egy dublett.
a dolgok még érdekesebbek, ha két közeli proton van. Ebben az esetben mindkét szomszédos protonnak van spinje. Bármelyik spin értéke +1/2 vagy -1/2 lehet. Lehet, hogy mindkettő +1/2. Lehet, hogy mindkettő -1/2. Talán mindegyikből van egy. Ez a három lehetséges kombináció három különböző hatással lesz az elektron által tapasztalt mágneses mezőre.
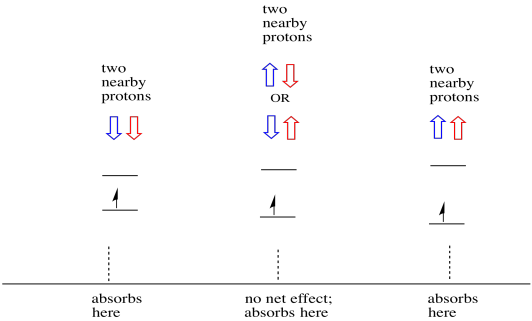
ennek eredményeként három csúcs van a spektrumban. A spektrumot hármasnak nevezik. Ez a triplett az alábbiakban látható, a diagram alatt, amely a szomszédos hidrogének spin-kombinációit szemlélteti.
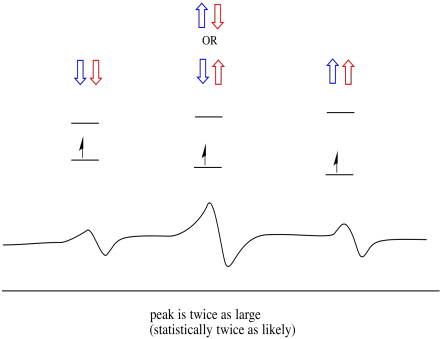
figyeljük meg, hogy mivel a hidrogén akár felfelé, akár lefelé is lehet A vegyes kombinációban, kétféle módon lehet elérni ezt a középső állapotot. Ez a kombináció kétszer olyan valószínű, mint a másik kettő, mert csak egy módon lehet megszerezni ezeket a kombinációkat: mindkét hidrogén forog, egy esetben. Mindkét hidrogén lecsökkent a másikban. Ennek eredményeként a hármas középső csúcsa kétszer akkora, mint a széleken lévő csúcsok.
gyakorlat \(\PageIndex{1}\)
azt mutatják, hogy három szomszédos hidrogénnel egy kvartett jön létre, amelyben a csúcsok aránya 1:3:3:1.
válasz
a kombinációk:
a) minden pörgetés lefelé (és ennek csak egy módja van)
b) két pörgetés lefelé, de az egyik felfelé (és a három proton mindegyike felfelé lehet, tehát ennek három módja van)
c) két pörgetés felfelé, de az egyik lefelé (és a három proton mindegyike lefelé lehet, tehát ennek három módja van)
d) minden pörgetés lefelé (és csak egy módja van hogy).
az eredmény egy 1:3:3:1 kvartett.
gyakorlat \(\PageIndex{2}\)
jósolja meg az EPR spektrum sokaságát a következő alkoxi-gyökök mindegyikére (vegye figyelembe, hogy az oxigénnek és a szénnek nincs párosítatlan pörgetése; tegyük fel, hogy ugyanez igaz X-re is):
a) X3C-O. b) X2CH-O. c) XCH2-O. d) CH3-O.
válasz a)
a) szingulett
válasz b)
b) kettős
válasz C)
C) triplett
válasz d)
d) kvartett
gyakorlat \(\pageindex{3}\)
tegyük fel, hogy a benzolt egy elektronnal redukáljuk a Benzolgyök anion előállításához. Mi lenne az EPR spektrumának sokfélesége?
válasz
egy septet (a 1:3:5:7:5:3:1 arány).
Fémionokhoz való kapcsolódás
a hidrogéntől eltérő sok atommagnak nettó spinje van. Ha a párosítatlan elektron véletlenül megtalálható egy fémen, az EPR spektrum megerősítheti ezt a szerkezeti információt. Ez a megerősítés származhat mind a mágneses mező információjából (hasonlóan az NMR kémiai eltolódásához), mind a sokaságból.
a kiválasztott Fémek nukleáris pörgetései az alábbiakban láthatók.
| fém | Spin |
| v | 7/2 |
| Mn | 5/2 |
| Fe | 0 |
| co | 7/2 |
| cu | 3/2 |
ezen fémek mindegyikében a mag különböző lehetséges mágneses mezőkkel rendelkezik. Vegye figyelembe, hogy hatásuk valamivel bonyolultabb, mint egy hidrogénatomé. Például a réz, a spin 3/2-vel, kicsit úgy viselkedik, mint három különböző hidrogénmag (mindegyik spin +/- 1/2) a közeli elektrom EPR spektrumára gyakorolt hatása szempontjából. A páratlan elektron sokaságának egy rézionon elég megkülönböztetőnek kell lennie.
gyakorlat \(\PageIndex{4}\)
jósolja meg az EPR spektrum csúcsának sokaságát egy párosítatlan elektron számára a következő fémek mindegyikén:
a) vanádium b) mangán c) vas d) kobalt e) réz
válasz A)
A) egy oktett (egy 1:3:5:7:7:5:3:1 válasz b)
b) a szextett (1:3:5:5:3-ban:1 arány)
válasz c)
c) szingulett
válasz d)
d) oktett
válasz e)
e) kvartett (1:3:3:1 arányban)
néha a dolgok bonyolultabbak, mert ugyanazon elem különböző izotópjainak különböző lehetséges spinértékei lehetnek. Valójában ez igaz a hidrogénre és a szénre, de a hidrogén nagy többsége 1H, tehát általában úgy gondolhatunk rá, hogy spin = 1/2; a szén nagy többsége 12C, spin = 0.
a vas természetes izotópjait és azok nukleáris forgását az alábbi táblázat mutatja.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. A mintán belül az elektronok egy része vasionokon helyezkedne el spin = 1/2, bár a legtöbb nem. Ez a komplikáció elegendő lehet a spektrum megjelenésének enyhe változásának bevezetéséhez, de összességében még mindig nagyjából úgy nézne ki, mint egy szingulett.
azonban sok esetben a dolgok sokkal összetettebbé válnak. A molibdén jó példa.
| izotóp | Spin | % Abundancia |
| 92mo | 0 | 14,8 |
| 94mo | 0 | 9.3 |
| 95Mo | 5/2 | 15,9 |
| 96Mo | 0 | 16,7 |
| 97Mo | 5/2 | 9,6 |
| 98mo | 0 | 24,1 |
| 100mo | 0 |
a molibdénnek hét természetben előforduló izotópja van. Öt közülük spin = 0, tehát egy párosítatlan elektron ezeken az izotópokon egyszerű szingulettet eredményezne az EPR spektrumban. A másik két izotóp, amely a teljes mennyiség 25% – át teszi ki, spin = 5/2. A molibdén legtöbb párosítatlan elektronja szingulettként jelenik meg. Azonban, jelentős hányad jelenik meg szextettként. Ez azt jelenti, hogy ideális esetben egy párosítatlan elektron a molibdénen egy szingulettet eredményezne, amelyen egy szextett helyezkedik el (körülbelül egynegyede olyan erős, mint a szingulett).
Ez a helyzet úgy néz ki, mint az alábbi rajz.
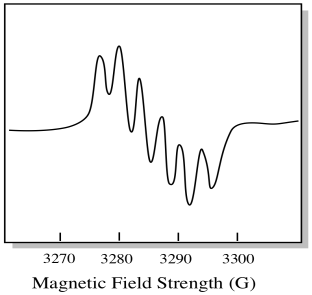
a valóságban az EPR spektrumok sok esetben rendkívül bonyolultak. Gyakran úgy néznek ki, mint a fuzzy foltok. Olyan sok dolog kapcsolódik olyan sok más dologhoz, hogy szinte lehetetlenné válik szemmel megfejteni. A legtöbb esetben számítógépes szimulációkat futtatnak, és a kísérleti adatokat összehasonlítják a számítógépes szimulációkkal, hogy strukturális betekintést nyerjenek.
Exercise \(\PageIndex{5}\)
vanádium van jelen néhány nitrogénázban, ezért érdeklődés mutatkozott a modellkomplexek iránt (pl. Sandro Gambarotta et al, J. Am. Kémia. Soc. 1994, 116, 6927-6928). A Gambarotta a következő szintézist alkalmazta THF oldószerben:
\(\ce{VCl3 + K -> 3V (THF)}\)
- rajzolja meg a reakció termékének szerkezetét.
- Rajzolj egy d orbitális hasítási diagramot erre a komplexre.
- EPR spektrumot rögzítettünk erre a vegyületre. Vázolja fel a spektrumot, tekintettel arra, hogy a vanádium nukleáris spinje I = 7/2.
- becsülje meg a vegyületre vonatkozó 6x értéket.
a vegyület reakcióba lép N2, N2-áthidalt dimert képezve.
E) rajzolja meg a termék szerkezetét.
f) ez a vegyület nem termel EPR spektrumot. Adjon meg egy (e) rezonancia struktúrát, amely megmagyarázza ezt a megfigyelést.
válasz
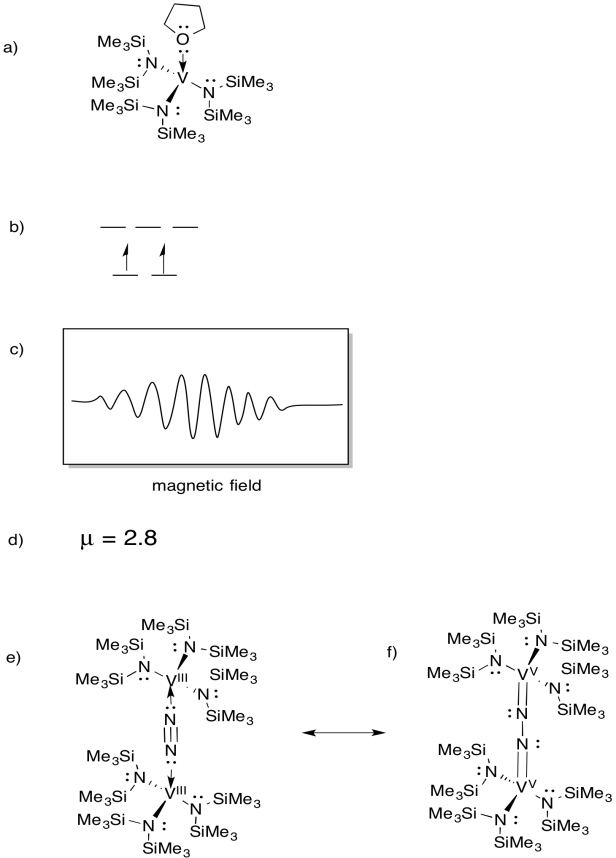
az EPR spectra a Virtual Imagination / Slapdash Chemistry Creations jóvoltából biztosított.
hozzárendelés
Chris P Schaller, Ph. D., (Szent Benedek Főiskola / Szent János Egyetem)