- Bevezetés
- anyagok és módszerek
- műszeres analízis
- Közegkészítmény
- a Drostanolone Enanthate (1) fermentációját a C. aphidicola ATCC 28300 és az F. lini NRRL 2204
- 2 ons-metil-3,14,17 fő-trihidroxi-5 fő-androsztán (2)
- 2α-Metil-7α-hidroxi-5α-androsztán-3,17-dione (3)
- 2α-Metil-3α,17β-dihidroxi-5α-androsztán (4)
- 2-Metilandroszta-1,4-dién-3,17-Dion (5)
- 2-Metilandroszta-11 6-hidroxi-1,4-dién-3,17-Dion (6)
- 2-Metilandroszta-14 6-hidroxi-1,4-dién-3,17-Dion (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- eredmények és vita
- struktúra tisztázása
- citotoxicitás a HeLa, PC3, H640 és HCT116 rák, valamint a 3T3 normál sejtvonalak ellen
- szerkezet-aktivitás összefüggés
- következtetés
- szerzői hozzájárulások
- összeférhetetlenségi nyilatkozat
- elismerések
- Kiegészítő anyag
Bevezetés
mikrobiális transzformáció az egyik legfontosabb megközelítések a szerkezeti átalakulás különböző osztályok szerves vegyületek. Ezt a technikát sikeresen alkalmazták a zöld kémiában, azaz. a gyógyszerfelfedezési és fejlesztési programok, amelyek kiváló vegyületforrást biztosítanak a magszerkezetek körül, majd különböző biológiai tevékenységek szűrését követik. Számos esetben a mikrobiális transzformációt fontos eszközként használták a szerves vegyületek regio-, kemo-és sztereo-szelektív átalakításához, amelyeket hagyományos módszerekkel nehéz elérni (Holland and Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). A szteroidok szénhidrogénvázának inaktív jellege miatt gyakran nehezen deriválhatók hagyományos szintetikus módszerekkel. Ezért a mikrobiális transzformációt gyakran használják a szteroidok szerkezeti megváltoztatására. A P450 citokróm enzimrendszerek jelenléte a gombákban a teljes sejtes biokatalízist hatékony eszközzé teszi a sztereo-és regio-specifikus hidroxilezéshez (Choudhary et al., 2005a; Tong és Dong, 2009; Kristan és ri Xhamner, 2012; Baydoun et al., 2014).
a Drostanolone és észterei származékai, mint például a drostanolone propionát, a Drostanolone pentanoate és a drostanolone enanthate (1) anabolikus-androgén szteroidok (AASS), amelyeket a sportolók használnak az izmok erősítésére anélkül, hogy zsírt szereznének. Ezenkívül a drostanolone és észterszármazékai képesek gátolni az ösztrogén termelését. Propionát-észter drostanolone is használják a mellrák kezelésére, márkanév alatt Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al., 2002; Bahrke és Yesalis, 2004).
a rákot jelenleg jelentős közegészségügyi kihívásként ismerik el. A rák a második vezető halálok az Egyesült Államokban és az egész világon. Az Egészségügyi Világszervezet (WHO) szerint a rák előfordulása évente meghaladja a 6 millió esetet. A rákos sejtek magas proliferációs sebességgel rendelkeznek. Gyorsan terjednek az élő rendszerben, és képesek túlélni az erős kemoterápiás szerekkel és a DNS-károsító szerekkel szemben. Hasonlóképpen, a citotoxikus gyógyszereknek számos káros hatása van a normál sejtekre, ezért a rák kemoterápiában történő alkalmazásuk terápiás kihívást jelent. Emiatt sürgősen szükség van biztonságos, hatékony és szelektív kemoterápiás szerek kifejlesztésére a különböző rákos megbetegedések ellen (Munoz-Pinedo et al., 2012; Su et al., 2015; Swadogo et al., 2015; Rebecca et al., 2016).
a mellrák az egyik leggyakoribb rák a világ 140 országában. A rák okozta halálozás egyik fő oka a nőknél szerte a világon, amelyet a magas proliferációs arányú emlő lobulákban vagy csatornákban lévő sejtek abnormális növekedése jellemez (Hanahan and Weinberg, 2000; Ferlay et al., 2015).
a méhnyakrák a második leggyakoribb rák a nőknél az egész világon, az emlőrák után. A méhnyakrák fő oka a rosszindulatú sejtek kialakulása a méhnyak szöveteiben (Wang et al., 2013; Hafiza és Latifah, 2014; Pariente et al., 2016). Az emberi méhnyakrákos sejtekből nyert HeLa rákos sejtvonal egy közös sejtmodell a vizsgált vegyületek citotoxikus potenciáljának értékelésére.
a prosztatarák a második vezető rák a férfiaknál világszerte a bronchus rák után, és a harmadik leggyakoribb rákos halálok. Ez a férfiak rosszindulatú daganatának leggyakoribb oka. Előfordulása az életkorral növekszik, gyakoribb az 50 éves kor felett (Henry and Omahony, 1999; De-Bono et al., 2010; Wenbin et al., 2015). A PC-3 rákos sejtvonal, amelyet férfi prosztatarákos sejtekből nyernek, széles körben alkalmazott modell a vizsgált vegyületek toxicitásának vizsgálatára.
a tüdőrák az Egyesült Államokban a férfiak körében az 1950-es évek közepe óta, a nők körében pedig az 1980-as évek vége óta rendkívül elterjedt rák. ez a rákkal kapcsolatos halálozás vezető oka. A tüdőrákot leginkább a dohányzásnak tulajdonítják (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). Az emberi tüdőrákos sejtekből nyert h460 rákos sejtvonalat (az emberi nagysejtes tüdőkarcinóma limfogén metasztatikus alvonalát) gyakran használják a vizsgált vegyületek citotoxicitásának értékelésére.
a mell -, tüdő-és prosztatarák után a vastagbélrák a negyedik leggyakoribb rák az egész világon. Ez a rák körülbelül azonos gyakorisággal fordul elő férfiaknál és nőknél. Ez a rákkal kapcsolatos halálesetek második leggyakoribb oka a nyugati országokban (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). Az emberi vastagbélrákos sejtekből nyert HCT116 rákos sejtvonalat általában a vizsgált vegyületek citotoxicitásának értékelésére használják.
a bioaktív szteroidok gombás transzformációjával kapcsolatos tanulmányaink folytatásában (Choudhary et al., 2005b, c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017), szintetizáltuk a drostanolone Enanthate (1) analógjait a Cefalosporium aphidicola és a Fusarium lini átalakításával. A 2-9 metabolitokat, valamint az 1. szubsztrátot a HeLa (méhnyakrák), a PC-3 (prosztatarák), a H460 (tüdőrák), a HCT116 (vastagbélrák) és a 3T3 (egér fibroblaszt normál) sejtvonalakkal vizsgálták nagy áteresztőképességű sejtalapú vizsgálat segítségével, amely a leghatékonyabb és legkényelmesebb laboratóriumi módszer, az MTT vizsgálat a vizsgált vegyületek válaszának előrejelzésére rosszindulatú daganatokban, ahol specifitást mutattak a rákos sejtekkel szemben. Ez a tanulmány tehát azonosította a Drostanolone enanthate (1) rákellenes metabolitjait további vizsgálatokhoz.
anyagok és módszerek
műszeres analízis
vékonyréteg-kromatográfiát (TLC) (szilikagél, 20 60, 0,25 mm vastag, PF254, Merck, Németország) alkalmaztak a transzformáció és a tisztaság fokának elemzésére. Szilikagél oszlopkromatográfiát (70-230 mesh, E. Merck, Németország) használtunk a metabolitok kezdeti tisztítására. Ezenkívül a metabolitok végső tisztítására preparatív reverz fázisú újrahasznosítást (JAI LC-908w, Japán) alkalmaztak, YMC L-80-mal felszerelve (4-5 db, 20-50 mm ID). A metabolitok szerkezetét az 1H- (400, 500 és 600 MHz), valamint a 13C-NMR (100, 125 és 150 MHz) spektrumok segítségével tisztázták, amelyeket a Bruker Avance-NMR spektrométereken (Franciaország) rögzítettek CD3OD, CD3COCD3 vagy DMSO-d6 formátumban. A HREI-MS és az IR spektrumokat JEOL JMS-600h (japán) (kettős fókuszú mágneses szektor tömegelemző) tömegspektrométeren (ei, electron impact ionization), illetve Bruker Vector 22 FT-IR spektrofotométeren végeztük. A metabolitok optikai forgását JASCO P-2000 polariméteren (Japán) rögzítették. Az Evolution 300 UV-látható spektrofotométert használták az UV spektrumok rögzítésére. A transzformált termékek olvadáspontjait Buchi M-560 (Svájc) műszerrel mértük. Egykristályos röntgendiffrakciós adatokat gyűjtöttek a Bruker APEXII D8 Venture Diffraktométeren, foton 100 detektorral (CMOS technológia) és Finomfókuszú zárt csővel, röntgensugár-forrással (cu Ka sugárzás = 1,54178). A reflexiós intenzitásokat SAINT szoftver segítségével integráltuk. Az abszorpciós korrekciót több szkenneléssel végezték, és a struktúrát SHELXTL programmal oldották meg (Gerlier and Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
A C. aphidicola ATCC 28300 és az F. lini NRRL 2204 mikrobiális tenyészeteit az American Type Culture Collection (ATCC) és az Northern Regional Research Laboratories (Nrrl) végezte. A tenyészeteket Sabouraud dextróz agaron (SDA) ferdén termesztettük, és 4 CAC-n tartottuk.
Közegkészítmény
négy liter közeg a C. aphidicola ATCC-28300-at 200 g glükóz, 4 g KH2PO4, 8 g glicin, 4 g KCl, 8 g MgSO4.7h2o és 8 mL nyomelem 4 liter desztillált vízben történő összekeverésével állítottuk elő. Hasonlóképpen négy liter közeget állítottunk elő az F. lini NRRL 2204-hez 40 g glükóz, 20 g élesztőkivonat, 20 g pepton, 20 g KH2PO4, 20 g NaCl és 40 mL glicerin 4 liter desztillált vízben történő összekeverésével.
a Drostanolone Enanthate (1) fermentációját a C. aphidicola ATCC 28300 és az F. lini NRRL 2204
táptalajjal a C. aphidicola és az F. lini növekedésére úgy állítottuk elő, hogy a fent említett összetevőket 4 liter desztillált vízben összekeverjük minden egyes gomba számára, amelyet ezután egyenlően adagoltunk 40 Erlenmeyer lombikba 250 mL (minden lombikban 100 mL). Mindezeket a lombikokat 121 Kb-nál autoklávozták, és sterilizált körülmények között a C. aphidicola ATCC 28300 és az F. lini NRRL 2204 SDA ferdékkel oltották be. Ezeket a gombakultúrákat tartalmazó lombikokat a rotációs rázógépen (121 fordulat / perc) 26! 2! C-on 3-4 napig hagyták, hogy a C. aphidicola és az F. lini maximális növekedését érjék el. Az 1-es vegyületet (1 g) gombánként 20 mL acetonban oldottuk fel, és minden lombikban 0,5 mL-t adtunk ki, majd ismét rotációs rázógépre helyeztük 12 napig. Negatív kontrollt (közepes + gombatenyészet), valamint pozitív kontrollt (közepes + szubsztrát) is készítettünk analóg módon az 1. vegyület gombás metabolitjainak, illetve lebomlásának értékelésére. 12 napos inkubálás után az összes lombikot leszűrtük és 20 Liter diklór-metánnal (DCM) extraháltuk, a szerves fázist elválasztottuk, majd csökkentett nyomáson rotációs bepárlón elpárologtattuk. Ez 1,5 g halvány sárgás szilárd nyersanyagot eredményezett. Ezt a nyers anyagot szilikagél oszlopkromatográfiával frakcionáltuk gradiens hexánokkal és aceton oldószeres rendszerekkel végzett elúcióval. Az oszlopkromatográfia négy fő frakciót (1-4) eredményezett, amelyeket ezután a HPLC újrahasznosításával tisztítottak. A 2 (tR = 16 perc, 8 mg, 0,8%), 3 (tR = 19 perc, 11 mg, 1,1%), 4 (tR = 17 perc, 35 mg, 3,5%), 5 (tR = 23 perc, 42 mg, 4,2%), 6 (tR = 20 perc, 9 mg, 0,9%), 7 (tR = 21 perc, 12 mg, 1,2%) és 9 (tR = 18 perc, 5 mg, 0,5%) metabolitot tisztítottuk a frakciók 1-7, illetve a fordított fázisú újrahasznosítás HPLC alkalmazásával metanol – víz oldószerként rendszer (meoh: H2O; 70: 30). Míg a 8-as metabolitot a 8-as frakcióból nyertük normál fázisú újrahasznosítási HPLC (tR = 32 perc, CHCl3: MeOH; 95: 5, 7.5 mg, 0, 75%).
2 ons-metil-3,14,17 fő-trihidroxi-5 fő-androsztán (2)
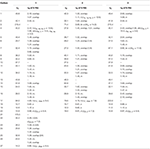
1. táblázat. 13C-és 1H-NMR kémiai eltolódási adatok (J és W1/2 Hz-ben) az 1-3 vegyületekről (ppm).
2α-Metil-7α-hidroxi-5α-androsztán-3,17-dione (3)
2α-Metil-3α,17β-dihidroxi-5α-androsztán (4)
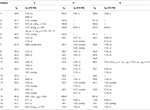
2. Táblázat. 13C-és 1H-NMR kémiai eltolódási adatok (J és W1/2 Hz-ben) a 4-6 vegyületek esetében (ppm).
2-Metilandroszta-1,4-dién-3,17-Dion (5)
2-Metilandroszta-11 6-hidroxi-1,4-dién-3,17-Dion (6)
2-Metilandroszta-14 6-hidroxi-1,4-dién-3,17-Dion (7)
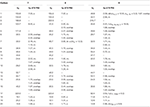
3. táblázat. 13C-és 1H-NMR kémiai eltolódási adatok (J és W1/2 Hz-ben) a 7-9 vegyületek esetében (6 ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. A sejtvonalakat DMEM F12 táptalajban termesztettük, kiegészítve 10% FBS – sel 5% CO2 atmoszférában, inkubátorban 37 Kb-nál.
az MTT kolorimetriás vizsgálatot használtuk a sejtek metabolikus aktivitásának értékelésére. Ebben a vizsgálatban a sárga MTT lila formazonná redukálódik az élő sejtek mitokondriumában (Gerlier and Thomasset, 1986). Minél több az élő sejtek, annál több a szín, és így több abszorbancia figyelhető koloriméter (Fesahat et al., 2015). Ezt a módszert alkalmaztuk transzformált termékeink rákos sejtekkel szembeni sejtes citotoxicitásra gyakorolt hatásának elemzésére. Minden sejtvonalból körülbelül 10 000 sejtet (HeLa, PC3, H460, HCT116 rák és 3T3 normál) vetettek be 96 lyukú lemezekbe. A 80-90% – os összefolyás elérése után különböző koncentrációjú vegyületekkel kezeltük őket (25, 50, 75, 100 és 200 Ft) 24 órán át. az összes vegyületet steril DMSO-ban oldottuk, hogy 200 mM-es törzsoldatot kapjunk. Az oldatot leszűrtük, majd sorozatos hígításokat végeztünk táptalajban. Minden hígításból 600 6L-t használtunk 3 kút (mindegyik három példánya) kezelésére 96 kútlemezből, azaz egyenként 200 6L-ből. Minden kísérletet három biológiai ismétlésben végeztünk. MTT-t adtunk hozzá, és 4 órán át inkubáltuk. az MTT eltávolítása után a lila formazonkristályokat feloldottuk DMSO-ban, és a normál és a rákos sejtek esetében 540, illetve 570 nm-en észleltük a leolvasást. A Multiskan olvasó 540 nm-en adja meg a DMSO-val kezelt 3T3 fibroblaszt sejteket (amelyek morfológiájukban összefolyóbbak), míg a rákos sejtek esetében 570 nm-t ad 6max (Bonmati-Carrion et al., 2013; Danihelov stb., 2013). Az epitheliális carcinoma sejtvonalak széles skáláját alkalmazták ebben a kísérletben, ahol a ciszplatin gyakori választott gyógyszer volt. Megcélozza a DNS-t, zavarja a sejtosztódást a mitózis során, és apoptózist indukál (Eastman, 1999). Az IC50 értékeket úgy számítottuk ki, hogy meghatározzuk a sejtek 50% – ának elpusztításához szükséges minimális koncentrációt.
mivel,
At = a vizsgált vegyület Abszorbanciaértéke
AB = a vakpróba Abszorbanciaértéke
AC = a kontroll Abszorbanciaértéke
eredmények és vita
struktúra tisztázása
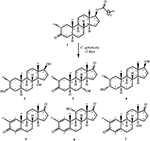
1. ábra. A Drostanolone enanthate (1) biotranszformációja Cefalosporium aphidicolával.
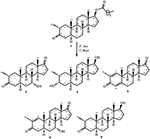
2. ábra. Biotranszformációja Drostanolone enanthate (1) a Fusarium lini.
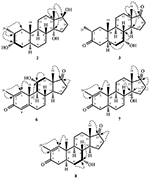
a 2-es metabolitot fehér kristályok formájában izoláltuk. A c20h30o3 molekulaképlet HREI-MS-en alapult, amely az at m/z 322.2517 (calcd. 322.2508, C20H34O3), ami három hidrogén és egy oxigénatom hozzáadására, a C-3 keton-karbonil redukciójára és a heptanoát oldallánc hidrolitikus hasítására utal az 1.szubsztrátban. A 3531−es és 3423 cm-1-es IR abszorbancia a hidroxilcsoportok jelenlétének volt köszönhető. Az 1H-NMR spektrum további metinprotonjelet mutatott a 3.69-es fővonalnál (1.táblázat) (2. adatlap). A heptanoát oldallánc jelét szintén hiányosnak találták a vegyület 1H-NMR spektrumában 2. A 13C-NMR spektrum jeleket mutatott egy új Metin szénre 71,4-nél, és egy új kvaterner szénre 84,8-nál. A heptanoát lánc és a keton karbonil szénjelei szintén hiányoztak a 13C-NMR spektrumból. Ez a C-3 karbonil csökkenését, a heptanoátlánc hidrolitikus veszteségét és OH hozzáadását javasolta a C-14-hez (1.táblázat). Az OH csoportot a H3-3 hmbc korrelációja alapján helyeztük el H3-20 (0,91, D) és C-3 (71,4) (3.ábra). Ez a C-3 karbonil redukciójának eredménye. A második OH csoportot a C-14-re helyeztük, a H3-18 (0,81 s) és a C-14 (84,8) hmbc korrelációja alapján. A harmadik OH A C-17-nél volt, a heptanoát rész hidrolitikus veszteségéből származott. A C-3-as O-H Csoportot a H-3 NOESY-korrelációi alapján 6CC-orientáltnak minősítették (3.69, br. a H-2 (1,64, átfedés) és a H3-20 (0,91, d) (4.ábra). Az OH-14-et arra a következtetésre jutottuk, hogy a H-9 NOESY korrelációi (1,32, m) az OH-14-gyel (2,66, s) (aceton-d6). Az egykristályos röntgendiffrakciós analízis tovább támasztotta alá a 2-es metabolit szerkezetét, amely három gyűrűből áll a szék konformációjában (A, B és C), és egy a burok konformációjában (D). A C-3-as, C-14-es és C-17-es OH-csoportokba három OH-csoportot osztottak be, melyek a következők voltak: (5.ábra). A 2-es metabolit egykristályos diffrakciós adatait benyújtották a Cambridge-i kristálytani adatgyűjtéshez (CCDC 1500706). A 2-es metabolit szerkezetét tehát úgy határoztuk meg,hogy 2 fő-metil-3 fő -, 14 fő -, 17 fő-trihidroxi-5 fő-androsztán.
3. ábra. Kulcsfontosságú hmbc ( ) és hangulatos (
) és hangulatos ( ) korrelációk az új metabolitokban.
) korrelációk az új metabolitokban.
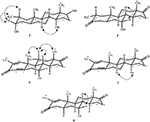
4. ábra. A legfontosabb NOESY korrelációk az új metabolitokban.
a 3-as metabolitot fehér szilárd anyag formájában nyertük. A HREI-MS megjeleníti az at m/z 318.2192 (calcd. 318.2195, C20H30O3). Ez a heptanoát oldallánc elvesztését, valamint egy oxigénatom hozzáadását jelentette az 1. szubsztrátban. Az IR spektrum abszorbanciát mutatott OH (3436 cm−1) és keton karbonilok (1711 cm−1) esetében. Az 1H-NMR spektrumban a heptanoát lánc és a C-17 Metin proton jeleit hiányzónak találták, míg egy új downfield Metin proton jelet figyeltek meg a 3.92-nél (1.táblázat) (3. adatlap). Ez a szteroid csontváz hidroxilációjára és a heptanoát rész oxidatív hasadására utalt. A 13C-NMR spektrum szintén alátámasztotta a fenti következtetéseket. A heptanoát rész szénjelei hiányoztak, míg egy új keton-karbonil és egy oxi-Metin jel jelent meg a 13C-NMR spektrumban (1.táblázat). Ez a heptanoátlánc oxidatív hasadását és hidroxilezését jelezte az 1. szubsztrátban. Az újonnan megjelent Metin proton 3,92 (H-7)-nél hmbc korrelációt mutatott a C-5-tel és a C-8-mal, ami OH-ra utal a C-7-nél (3.ábra). A H3-18 és a H2-16 hmbc korrelációi a 223,8-as számú szénnel ketonszénre utaltak a C-17-esben. Az OH-T A C-7-nél a H-7 és a H2-6 és a H-8 hangulatos korrelációi is alátámasztották. A H-7 (3.92, s) NOESY korrelációt mutatott a tengelyirányban orientált H-8-mal (1.70, átfedés), ami Oh-t javasolt a C-7-nél (4.ábra). Így a 3-as metabolit szerkezetét 2-ként határoztuk meg 6-metil-7-6-hidroxi-5-6-androsztán-3,17-Dion.
egykristályos röntgendiffrakciós analízist végeztek az 1-es és 5-ös vegyületeken is. Az 1. vegyület négy gyűrűből állt, azaz a, B, C és D székkel, székkel, székkel és boríték konformációkkal. A C-2-ben metil volt jelen Egyenlítői orientációval. A heptanoát-észter lánc jelen volt a D gyűrű C-17-ben (6.ábra). Míg az 5 metabolit a, B, C és D gyűrűket tartalmaz gyalu, szék, szék és boríték konformációkban. A heptanoát oldallánc nem volt jelen az 5-ös metabolitban (7.ábra). Az 1-es és 5-ös metabolitok egykristályos diffrakciós adatait benyújtották a Cambridge Crystallographic Data Collection-nek (CCDC 1500705, illetve CCDC 1500707). Az 1., 2. és 5. vegyületek egykristályos röntgendiffrakciós analízisének adatait a 4. táblázat tartalmazza.
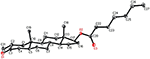
6. ábra. Számítógéppel generált ORTEP rajz az 1. vegyület végső Röntgenmodelljéről. Színkódok: szén, fekete; oxigén, piros.
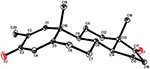
7. ábra. Számítógép által generált ORTEP rajz az 5. vegyület végső Röntgenmodelljéről. Színkódok: szén, fekete; oxigén, piros.

4. táblázat. Az 1-es, 2-es és 5-ös vegyületek egykristályos röntgendiffrakciós analízise.
citotoxicitás a HeLa, PC3, H640 és HCT116 rák, valamint a 3T3 normál sejtvonalak ellen
természetes termékek, például flavonoidok, szteroidok, terpének stb. kiváló forrásként szolgálhat számos gyógyszer előállításához, mivel számos biológiai tevékenységről, például rákellenes, gyulladáscsökkentő, leishmanialis, antibakteriális tevékenységről stb. Ezért szükséges, hogy derivatize őket, hogy tanulmányozza a szerkezet-aktivitás kapcsolat, amely hasznos lehet a szintézis biztonságos és hatékony gyógyszerek. Jelenleg számos gyógyszerkészítmény hatékonyan szintetizálódik mikrobiális biotranszformáció révén, mivel számos enzim van jelen bennük. A Drostanolone (9), a drostanolone propionát és a drostanolone heptanoate (1) jelentett rákellenes aktivitása alapján az 1-9 vegyületeket a HeLa, a PC-3, A H460 és a HCT116 rákos sejtvonalak elleni citotoxicitásra értékelték. Érdekes módon minden vegyület mérsékelt vagy erős rákellenes aktivitást mutatott. Az 1-9 vegyületek rákellenes aktivitását a HeLa (humán méhnyakrák), PC-3 (humán prosztatarák), H460 (humán tüdőrák) és HCT116 (humán vastagbélrák) elleni IC50 értékekből következtették (5.táblázat). Ezen eredmények alapján ezeknek a vegyületeknek a citotoxicitását a 3T3 (egér fibroblaszt) normál sejtvonalhoz viszonyítva is értékelték, ahol a 8 (IC50 = 74,6 3,7 6 m) és a 9 m (IC50 = 62,1 m 1,2 m) kivételével valamennyi vegyület nem citotoxikus.

5. táblázat. Az 1-9 vegyületek citotoxicitása a HeLa, PC3, H460 és HCT116 rák, valamint a 3T3 normál sejtvonalak ellen.
szerkezet-aktivitás összefüggés
a metabolitok szerkezetének változásai befolyásolták rákellenes aktivitásukat. Az észter rész hiányában a 2-es metabolit, a C-3-as és a C-14-es csoportnál két aO-H Csoport, A C-17-es csoportnál pedig egy ao-H Csoport alacsonyabb citotoxicitást mutatott a HeLa, a H460 és a HCT116 ráksejtvonalakkal szemben, de rákellenes aktivitása magasabb volt a PC-3 ráksejtvonallal szemben az 1-es vegyülethez képest. A 3-as metabolit az észter-csoport és két keto-csoport elvesztésével a C-3-ban, a C-17-ben és az aO-H-csoportban a C-7-ben szintén alacsonyabb aktivitást mutatott a HeLa, a H460 és a HCT116 rákos sejtvonalakkal szemben, de a PC-3 rákos sejtvonalakkal szemben fokozott aktivitást mutatott az 1-es szubsztráthoz képest. A C-3 karbonil O-H-vá történő redukciója és az észterrész hidrolitikus hasítása a 4. vegyületben bizonyos mértékben növelte aktivitását mind a HeLa, mind a PC-3 ráksejtvonalakkal szemben, de a h460 és HCT116 ráksejtvonalakkal szembeni rákellenes aktivitása csökkent az 1.szubsztráthoz képest. A C = C jelenléte a C-1/C-2 és a C-4/C-5 között, valamint a C = O A C-3 és a C-17 között az 5-ös metabolitot hatékony rákellenes szerré tette a HeLa rákos sejtvonal ellen, összehasonlítva az 1-es szubsztráttal és a standard gyógyszerrel (ciszplatin). Ezenkívül a PC-3 rákos sejtvonallal szembeni rákellenes aktivitása is megnövekedett az 1. szubsztráthoz képest. Érdekes módon a rákellenes aktivitása a H460 és a HCT116 rákos sejtvonalakkal szemben alacsonyabb volt az 1.vegyülethez képest. A C = C jelenléte a C-1/C-2 és a C-4/C-5 között, a C = O A C-3-nál és a C-17-nél, valamint az aO-H Csoport a C-11-nél a 6-os metabolitban növelte rákellenes aktivitását a HeLa-val és a PC-3 ráksejtvonalakkal szemben az 1-es szubsztráthoz képest, és hasonló rákellenes potenciált mutatott a HeLa ráksejtvonallal szemben, mint a standard gyógyszer (ciszplatin). A H460 és a HCT116 rákos sejtvonalakkal szembeni rákellenes aktivitása azonban csökkent az 1. vegyülethez képest. A C = C jelenléte a C-1/C-2 és a C-4/C-5 között, C = O A C-3-nál és a C-17-nél, valamint az aO-H Csoport a C-14-nél a 7-es metabolitban ismét növelte rákellenes aktivitását a HeLa-val és a PC-3 ráksejtvonalakkal szemben, és csökkentette rákellenes aktivitását a H460 és a HCT116 sejtvonalakkal szemben az 1-es szubsztráthoz képest. A C = C jelenléte a C-1/C-2-nél, a C = O A C-3-nál és a C-17-nél, valamint az aOH jelenléte a C-7-nél a 8-as metabolitot tette a leghatásosabb rákellenes hatásúvá a HeLa rákos sejtvonallal szemben az 1-es szubsztráthoz és a standard gyógyszerhez (ciszplatin) képest. Szintén jó aktivitást mutatott a PC – 3 rákos sejtvonallal szemben, de csökkentette a rákellenes aktivitást a H460 és a HCT116 rákos sejtvonalakkal szemben az 1 szubsztráthoz képest. A csak C-17 hidrolízissel rendelkező 9-es metabolit fokozott rákellenes aktivitást mutatott a HeLa, PC-3 és HCT116 ráksejtvonalakkal szemben, de csökkentette a h460 ráksejtvonalakkal szembeni citotoxicitást az 1-es szubsztráthoz és a standard gyógyszerhez (ciszplatin) képest. A fenti megbeszélések alapján arra lehet következtetni, hogy az 5-8 vegyületek fokozott rákellenes aktivitása a HeLa és a PC-3 ráksejtvonalakkal szemben valószínűleg a C = C jelenléte volt a C-1/C-2-nél, a karbonil-keton pedig a C-3-nál és a C-17-nél az 1-es szubsztráthoz képest.
következtetés
szerzői hozzájárulások
a bemutatott kutatás koncepcióját a MIC fejlesztette ki és tervezte. MIC volt a projekt felügyelője is. Az összes adatot MIC, A-t-W és HC elemezte és értelmezte. MS, SY, MA és NF végezte a kísérleteket. MIC, A-t-W és MS írta a kéziratot. Minden szerző felülvizsgálta a kéziratot. A kézirat végleges változatát a MIC is jóváhagyta a benyújtás előtt.
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
elismerések
A-t-W, és a MIC elismeri a felsőoktatási Bizottság, Iszlámábád, Pakisztán, a “Studies on the Chemoprevention of emlő Carcinogenesis by diétás szerek, (20-3790/NRPU/R& D/HEC/13/793).”Az SY elismeri az OPCW (Vegyifegyver-tilalmi Szervezet) pénzügyi támogatását egy” biotranszformációval nyert új anabolikus szteroidok szerkezeti és biológiai tanulmányai ” című kutatási projekt révén.”A HC elismeri a tudományos kutatás Dékánságának (DSR) pénzügyi támogatását, Abdulaziz Király Egyetem, Oktatási Minisztérium, Szaúd-Arábia.”
Kiegészítő anyag
Eastman, A. (1999). “A ciszplatin hatásmechanizmusa: az adduktumoktól az apoptózisig” a Ciszplatinban: Egy vezető daganatellenes gyógyszer kémiája és biokémiája, ed B. Lippert (Z ons: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002 / 9783906390420.ch4
CrossRef teljes szöveg | Google Tudós
Vardar, E., Vardar, S. A., and Cengiz, T. (2002). Anabolikus-androgén szteroid visszaélés. Anato. J. Pszichiátria 3, 104-107.