det finnes eksperimentelle metoder for påvisning av uparede elektroner. Et av kjennetegnene til uparede elektroner i materialer er samspill med et magnetfelt. Denne interaksjonen kan brukes til å gi informasjon om forbindelser som inneholder uparede elektroner.elektronparamagnetisk resonans (EPR) Eller elektronspinnresonans (ESR) er en spektroskopisk metode. Det avhenger av den energiske separasjonen av to spinntilstander som bare eksisterer i nærvær av et magnetfelt.
EPR er svært nært knyttet til EN annen vanlig type spin resonans spektroskopi, NMR.Spin Er en kvanteegenskap som ikke har noen reell analogi som vil gi mening for oss på et makroskopisk nivå. Vi vet imidlertid at spinn har forbundet med det magnetiske egenskaper. Et elektron kan ha en av to verdier for disse magnetiske egenskapene. Det er ulike etiketter gitt til disse verdiene: noen ganger «opp» og «ned», noen ganger +1/2 og -1/2. Men hvilken verdi av spinn et elektron har, gjør ingen forskjell energisk.
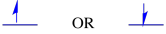
de to mulige spinntilstandene er de samme energisk-med mindre et magnetfelt er tilstede. Når den situasjonen oppstår, er det en energisk adskillelse mellom de to statene.
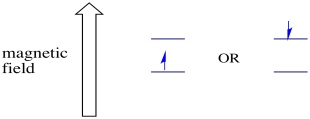
i nærvær av et magnetfelt separerer de to spinnstatene seg i to forskjellige energinivåer. Mengden separasjon mellom energinivåene avhenger av størrelsen på magnetfeltet. Jo sterkere magnetfeltet er, desto større er separasjonen.
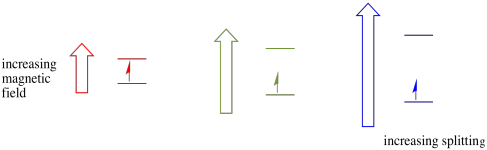
denne saken gjelder bare for uparede spinn. Husk at uparede spinn samhandler med et magnetfelt. Hvis alt er spin-paret, skjer ingenting. Det er veldig nyttig, fordi det gir oss en måte å oppdage de uparede elektronene på.
et elektron i en spinntilstand kan fortsatt være begeistret for den andre av absorbansen av en foton. Alternativt kan en elektron i høyere tilstand falle ned til den nedre hvis den frigjør en foton.
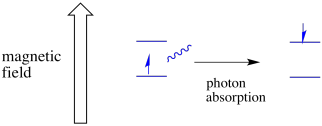
for at noe av dette skal skje, må fotonens energi nøyaktig matche energiforskjellen mellom stater. Denne Gullhår regelen kalles resonans tilstand. Mengden energi som leveres for å hoppe fra ett energinivå til det neste, må være helt riktig. For lite energi og elektronen vil ikke gjøre det. For mye energi og elektronen vil heller ikke gjøre det. Det venter på akkurat den rette fotonen.
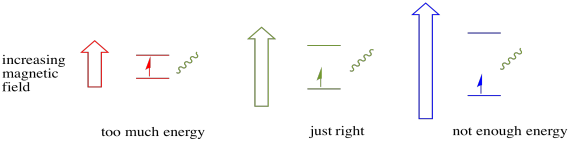
Hvor mye energi har et foton? Husk Planck-Einstein-forholdet ditt. Det beskrev energien til et foton:
\(E=h \nu \)
E Er energien til fotonet, h Er Plancks konstant (6.625 x 10-34 Js) og ν er frekvensen av fotonet (det ser Ut Som En Romersk vee, men det er det greske bokstaven, nu).
Alternativt, På grunn av forholdet mellom bølgelengde og frekvens:
\(E= \frac{hc}{\lambda}\)
de nye mengdene er c, lysets hastighet (3,0 x 108 m s-1) og λ, bølgelengden til fotonet.
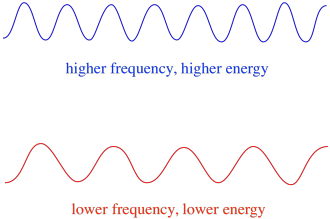
så generelt gir forskjellige bølgelengder av lys forskjellige mengder energi. Blått lys, med en bølgelengde nær 475 nm, har mer energi enn rødt lys, med en bølgelengde nær 700 nm.I EPR er det generelle spekteret av elektromagnetisk stråling, eller den generelle typen foton, mikrobølgestråling. Frekvensen av disse fotonene er omtrent 9 Eller 10 GHz. (En annen type spektroskopi, rotasjonsspektroskopi, måler også absorbansen av mikrobølger. Den bruker vanligvis noe høyere frekvenser av mikrobølger. Rotasjonsspektroskopi gir strukturell eller bindingsinformasjon om molekyler i gassfasen.)
Avhengig av miljøet til den uparede elektronen, kan det være mer utsatt eller mindre utsatt for påvirkning av det eksterne magnetfeltet. Det betyr at energi splitting mellom de to spinntilstandene vil variere fra ett molekyl til et annet. Som et resultat vil forskjellige molekyler i samme magnetfelt absorbere forskjellige bølgelengder av mikrobølgestråling.
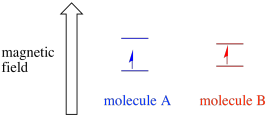
VANLIGVIS er ET EPR-spektrometer utformet slik at det leverer en fast bølgelengde mikrobølgestråling til prøven. Magnetfeltet justeres og instrumentet måler hvilken feltstyrke som var nødvendig for absorpsjon av fotonene. ET EPR-spektrum viser absorbans som en funksjon av magnetfeltstyrke.

DET er noe litt annerledes om HVORDAN EPR-spektra vanligvis vises. Den vises som et derivat av plottet vist ovenfor. Det er på grunn av måten instrumentet måler endringen i absorbans når det endrer magnetfeltet; dvs. det måler d (absorbans) / d (magnetfelt). Det er skråningen til den forrige tomten.
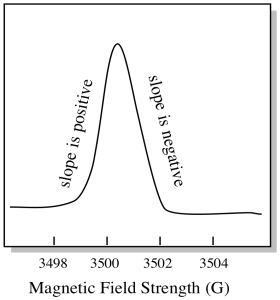
SOM et resultat ser ET EPR-spektrum mer ut som dette. Delen over grunnlinjen reflekterer den positive hellingen i forrige tomt. Delen under grunnlinjen gjenspeiler den negative hellingen i forrige tomt.
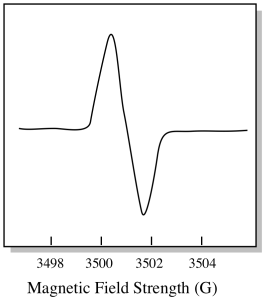
magnetfeltstyrken er vanligvis ikke verdien som rapporteres for toppposisjonen. I stedet rapporteres noe som kalles g-verdien. G-verdien oppstår fra ligningen For Zeeman-effekten (effekten av magnetfeltet på splittelsen mellom spinnenerginivåer). DET forholdet er:
\(\Delta E = g \beta B\)
I HVILKEN Δ er energiforskjellen mellom spinntilstander, g er g-verdien, en proporsjonalitetskonstant som avhenger av hvor mottakelig elektronen er for påvirkning av magnetfeltet, β Er Bohr magnetonet (9.274 x 10-24 J T-1) Og B er det påførte magnetfeltet.
Det betyr at for fotonabsorpsjon,
\(h \nu = g \beta B\)
og så
\(g = \frac{ h \nu}{\beta b}\)
Husk at h og β bare er konstanter. Det betyr at g er et mål på forholdet mellom fotonet absorbert og magnetfeltet som brukes. Det er et standardiseringstrinn. Hvis folk har instrumenter som bruker litt forskjellige bølgelengder av mikrobølgestråling, vil magnetfeltene de måler for de samme prøvene ikke være enige. Hvis alle bare måler forholdet mellom bølgelengde til feltstyrke, bør det hele ut. G-verdien er et reproduserbart mål for miljøet til et elektron som skal være det samme fra ett laboratorium til et annet.
EN lignende praksis brukes I NMR-spektroskopi, av lignende grunner. Når vi rapporterer et kjemisk skifte i ppm i stedet For Hz, korrigerer vi for styrken av magnetfeltet i instrumentet vi bruker. Ellers ville samme prøve gi to forskjellige skift på to forskjellige instrumenter.
Kobling I EPR
Kobling er et fenomen der magnetfelt samhandler med hverandre. I EPR kommer kobling på grunn av påvirkning av nærliggende kjerner på elektronen som blir observert.
for eksempel kan du allerede vite at et hydrogenatoms kjerne har et uparget spinn. Det er grunnlaget FOR 1H NMR spektroskopi. Hvis den kjernen har et uparget spinn, har det et tilhørende magnetfelt. Fordi hydrogenkjernen kan ha enten spinnverdi, +1/2 eller -1 / 2, så har den to mulige magnetfelt forbundet med den.et nærliggende elektron, plassert i et eksternt magnetfelt, kan nå være i en av to forskjellige situasjoner. Enten legger naboprotonet litt til magnetfeltet, eller det trekker litt fra det eksterne feltet.
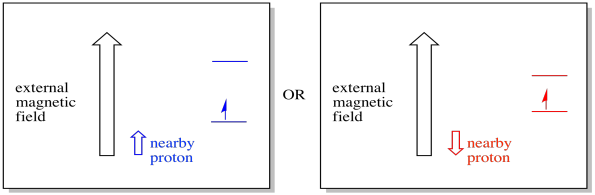
som et resultat kan elektronen oppleve to forskjellige felt. Husk at vi ikke har å gjøre med et enkelt molekyl i spektroskopi. Vi har å gjøre med et stort antall molekyler. Noen av molekylene vil være i en situasjon. Noen av molekylene vil være i den andre situasjonen. Vi vil se begge situasjonene. Det vil være absorbans ved to forskjellige magnetfeltstyrker.

SOM et resultat viser EPR-spekteret to topper, slik:
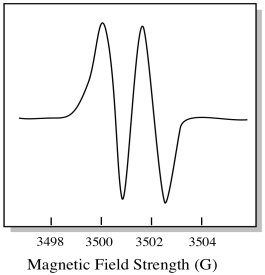
denne typen topp i spekteret kalles en dublett på grunn av den doble absorbansen. Denne egenskapen TIL EN EPR-topp kalles dens mangfold. Hvor mange linjer er toppen delt inn i? To. Det er en dublett.
Ting er enda mer interessante hvis det er to nærliggende protoner. I så fall har begge nærliggende protoner spinn. Enten spinn kan ha verdi +1/2 eller -1 / 2. Kanskje de er begge +1/2. Kanskje de er begge -1 / 2. Kanskje det er en av hver. Disse tre mulige kombinasjonene vil ha tre forskjellige effekter på magnetfeltet opplevd av elektronen.
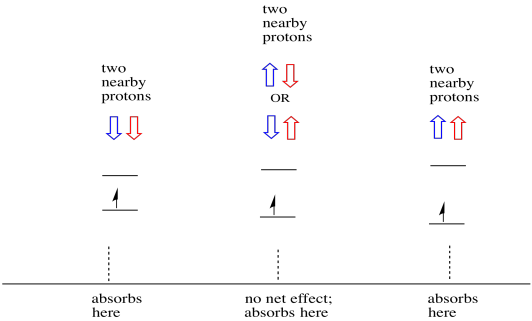
som et resultat er det tre topper i spekteret. Spekteret kalles en triplet. Denne tripletten er vist nedenfor, under diagrammet som illustrerer spinnkombinasjonene av nabohydrogenene.
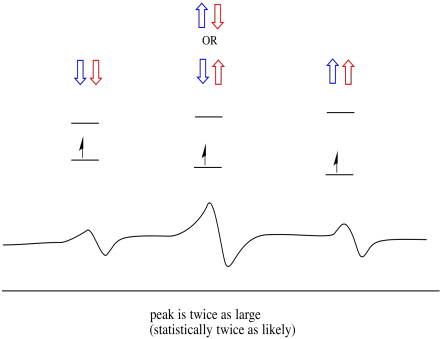
Legg merke til at fordi enten hydrogen kan være opp eller ned i den blandede kombinasjonen, er det to måter å komme til den midterste tilstanden. Den kombinasjonen er dobbelt så sannsynlig som de andre to, fordi det bare er en måte å få den kombinasjonen på: begge hydrogenens spinn er oppe, i ett tilfelle. Begge hydrogene er nede i den andre. Som et resultat er midtpunktet i en triplett dobbelt så stor som toppene på kantene.
Øvelse \(\PageIndex{1}\)
Viser at med tre nabohydrogener vil en kvartett resultere, hvor forholdet mellom toppene er 1:3: 3: 1.
Svar
kombinasjonene er: b) to av spinnene er nede, men det er tre måter å gjøre det på)
b) to av spinnene er nede, men en er oppe (og hver av de tre protonene kan være oppe, så det er tre måter å gjøre det på)
c) to av spinnene er oppe, men en er nede (og hver av de tre protonene kan være nede, så det er tre måter å gjøre det på)
d) alle spinner opp (og det er bare en måte å gjøre det på det).
resultatet er en 1:3:3: 1 kvartett.
Øvelse \(\PageIndex{2}\)
Forutsi mangfoldet I EPR-spektret for hvert av de følgende alkoksyradikaler (merk at oksygen og karbon ikke har noen uparede spinn; anta at Det samme gjelder For X):
a) X3C-O. b) X2CH-o. c) XCH2-O. D) CH3-O.
Svar a)
a) singlet
svar b)
b) doublet
Svar C)
c) triplet
svar d)
d) kvartett
øvelse \(\pageindex{3}\)
anta at benzen BLE REDUSERT MED EN elektron For Å Oppnå BENZEN RADIKAL ANION. Hva ville være mangfoldet I EPR-spekteret?
Svar
en septett (i en 1:3:5:7:5:3:1 forholdet).
Kobling Til Metallioner
Mange andre kjerner enn hydrogen har en netto spinn. Hvis den uparede elektronen blir funnet på et metall, KAN EPR-spektret gi bekreftelse på den strukturelle informasjonen. Denne bekreftelsen kan komme fra både magnetfeltinformasjonen (lik kjemisk skift I NMR) og fra mangfoldet.
Kjernespinn av utvalgte metaller er vist nedenfor.
| Metall | v | 7/2 |
| Mn | 5/2 |
i hver av disse metallene har kjernen forskjellige mulige magnetfelt. Legg merke til at deres effekter er litt mer kompliserte enn for et hydrogenatom. For eksempel virker kobber, med spinn 3/2, litt som tre forskjellige hydrogenkjerner (hver med spinn +/- 1/2) når det gjelder effekten på et nærliggende electroms EPR-spektrum. Mangfoldet av en upparet elektron på en kobberion bør være ganske karakteristisk.
Øvelse \(\PageIndex{4}\)
Forutsi mangfoldet av en topp I EPR-spektret for en upparet elektron på hvert av følgende metaller:
a) vanadium b) mangan c) jern d) kobolt e) kobber
Svar a)
a) en oktett (i a) 1:3:5:7:7:5:3:1 ratio)
Svar b)
b) en sekstett (i en 1: 3: 5: 5: 3:1 ratio)
Svar c)
c) en singlet
Svar d)
d) en oktett
Svar e)
e) en kvartett (i et 1:3:3:1-forhold)
Noen ganger er ting mer kompliserte, fordi forskjellige isotoper av samme element kan ha forskjellige mulige spinnverdier. Faktisk er det sant med hydrogen og karbon, men det store flertallet av hydrogen er funnet SOM 1H, så generelt kan vi tenke på det som å ha spinn = 1/2; det store flertallet av karbon ER 12C, med spinn = 0.
de naturlige isotoper av jern, og deres kjernefysiske spinn, er vist i tabellen nedenfor.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. Innenfor prøven ville noen av elektronene ligge på jernioner med spinn = 1/2, selv om de fleste ikke ville. Denne komplikasjonen kan være nok til å introdusere en liten variasjon i utseendet på spekteret, men generelt vil det fortsatt se ganske mye ut som en singlet.
men i mange tilfeller blir ting mye mer komplekse. Molybden er et godt eksempel.
| Isotop | Spinn | % Overflod | 92Mo | 0 | 14.8 |
| 94mo | 0 | 9.3 |
| 95Mo | 5/2 | 15,9 | 96Mo | 0 | 16,7 | 97Mo | 5/2 | 9.6 |
| 98mo | 24.1 | |
| 100mo |
det er syv naturlig forekommende isotoper av molybden. Fem av dem har spinn = 0, så en upparet elektron på disse isotoper vil gi opphav til en enkel singlet I EPR-spektret. De andre to isotoper, som omfatter 25% av totalen, har spinn = 5/2. De fleste uparede elektroner på molybden vil dukke opp som en singlet. Derimot, en betydelig brøkdel ville dukke opp som en sekstett. Det betyr at i et ideelt tilfelle vil en upparet elektron på molybden gi opphav til en singlet med en sekstett overlagret på den(omtrent en fjerdedel så sterk som singlet).
denne situasjonen kan se ut som tegningen nedenfor.
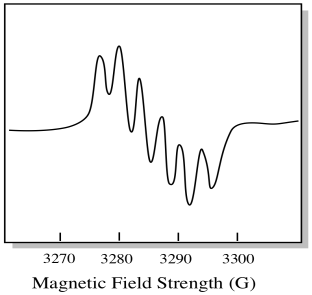
I virkeligheten ER EPR-spektra enormt komplisert i mange tilfeller. De ser ofte ut som fuzzy blobs. Det er så mange ting kobling til så mange andre ting at det blir nesten umulig å tyde for øyet. I de fleste tilfeller kjøres datasimuleringer og eksperimentelle data sammenlignes med datasimuleringene for å oppnå strukturell innsikt.
Øvelse \(\PageIndex{5}\)
Vanadium er tilstede i noen nitrogenaser og så har det vært interesse for modellkomplekser (F.Eks. Chem. Soc. 1994, 116, 6927-6928). Gambarotta brukt følgende syntese, I thf løsemiddel:
\(\ce{VCl3 + K- > 3V (THF)}\)
- Tegn strukturen til produktet av reaksjonen.
- Tegn en d orbital splitting diagram for dette komplekset.
- ET EPR-spektrum ble registrert for denne forbindelsen. Skisse spekteret, gitt at vanadium har kjernefysisk spinn i = 7/2.
- Anslå µ for denne forbindelsen.
forbindelsen reagerer Med N2, og danner En N2-brodd dimer.
e) Tegn strukturen til dette produktet.
f) denne forbindelsen produserer IKKE NOE EPR-spektrum. Gi en resonansstruktur av (e) som forklarer denne observasjonen.
Svar
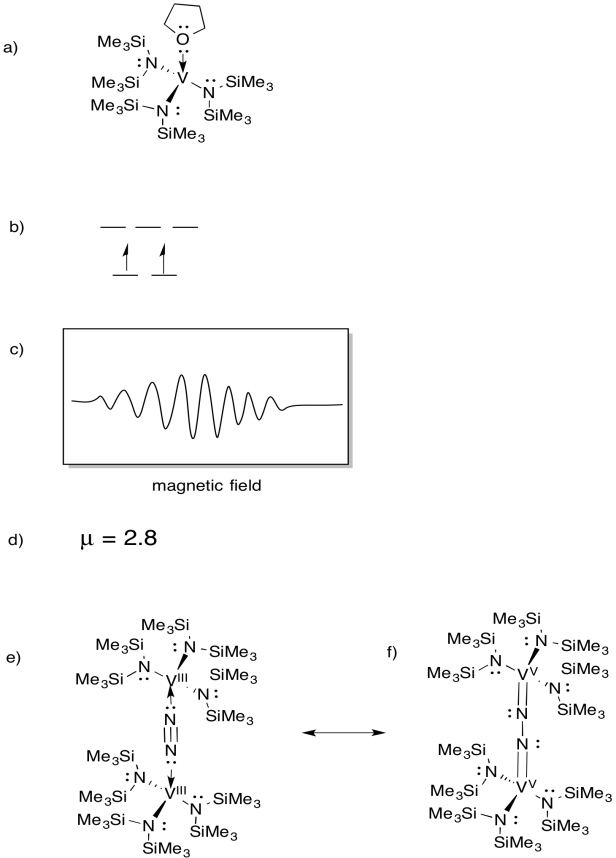
EPR spectra gitt høflighet Av Virtual Imagination / Slapdash Kjemi Kreasjoner.
Attribusjon
Chris P Schaller, Ph. D., (College Of Saint Benedict / Saint John ‘ S University)