- Introduksjon
- Materialer og Metoder
- Instrumental Analyse
- Mikrobielle Kulturer
- Media Forberedelse
- Gjæring Av Drostanolon Enanthate (1) Med c. aphidicola atcc 28300, Og F. lini NRRL 2204
- 2α-Metyl-3α,14α,17β-trihydroksy-5α-androstan (2)
- 2α-Methyl-7α-hydroxy-5α-androstan-3, 17-dione (3)
- 2α-Methyl-3α,17β-dihydroxy-5α-androstane (4)
- 2-Metylandrosta-1,4-dien-3,17-dion (5)
- 2-Metylandrosta-11α-hydroksy-1,4-dien-3,17-dion (6)
- 2-Metylandrosta-14α-hydroksy-1,4-dien-3,17-dion (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- Resultater og Diskusjon
- struktur elucidation
- Cytotoksisitet Mot HeLa, PC3, H640 Og HCT116 Kreft, OG 3T3 Normale Cellelinjer
- Struktur-Aktivitet Forhold
- Konklusjon
- Forfatterbidrag
- Interessekonflikt
- Bekreftelser
- Supplerende Materiale
Introduksjon
Mikrobiell transformasjon er en av de viktigste tilnærmingene for strukturell transformasjon av ulike klasser av organiske forbindelser. Denne teknikken har vært vellykket ansatt i grønn kjemi, dvs. legemiddeloppdagelses-og utviklingsprogrammer, som gir en utmerket kilde til forbindelser rundt kjernestrukturer, etterfulgt av screening for ulike biologiske aktiviteter. I flere tilfeller har mikrobiell transformasjon blitt brukt som et viktig verktøy for regio -, kjemo – og stereoselektive konverteringer av organiske forbindelser som er vanskelige å oppnå ved konvensjonelle metoder (Holland Og Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). Pa grunn av den inaktive naturen av hydrokarbonskjelett av steroider, er de ofte vanskelige a bli derivatisert av konvensjonelle syntetiske metoder. Derfor brukes mikrobiell transformasjon ofte til strukturell endring av steroider. Tilstedeværelsen Av p450 cytokrom enzymsystemer i sopp, gjør helcelle biokatalyse et effektivt verktøy for stereo -, og regio-spesifikk hydroksylering (Choudhary et al., 2005a; Tong Og Dong, 2009; Kristan Og Riž, 2012; Baydoun et al., 2014).Drostanolone, Og dets estere derivater, slik som drostanolone propionate, drostanolone pentanoate, og drostanolone enanthate (1) er anabole-androgene steroider (AASs) brukes av idrettsutøvere til å styrke sine muskler uten å få fett. I tillegg har drostanolon og dets estere derivater evnen til å hemme produksjonen av østrogen. Propionatester av drostanolon brukes også til behandling av brystkreft, under merkenavnet Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al.(2002; Bahrke og Yesalis, 2004).
Kreft er for tiden anerkjent som en stor folkehelseutfordring. Kreft er den nest største dødsårsaken i Usa, og over hele verden. Ifølge Verdens Helseorganisasjon (WHO) er forekomsten av kreft over 6 millioner tilfeller per år. Kreftceller har høy proliferasjonshastighet. De sprer seg raskt i det levende systemet, og kan overleve mot sterke kjemoterapeutika og DNA-skadelige stoffer. På samme måte har cytotoksiske stoffer mange bivirkninger på normale celler, og dermed er deres bruk i kreft kjemoterapi en terapeutisk utfordring. På grunn av dette er det nødvendig med utvikling av sikre, effektive og selektive kjemoterapeutiske midler mot ulike kreftformer (Munoz-Pinedo et al ., 2012; Et al., 2015; Swadogo et al., 2015; Anna et al., 2016).
Brystkreft Er en av de vanligste kreftene i 140 land i verden. Det er en viktig årsak til kreftrelatert død hos kvinner over hele verden, preget av unormal vekst av celler i brystlobulene eller kanalene med høy proliferasjonshastighet (Hanahan Og Weinberg, 2000; Ferlay et al., 2015).Livmorhalskreft Er den nest mest dominerende kreft hos kvinner over hele verden, etter brystkreft. Hovedårsaken til livmorhalskreft er dannelsen av ondartede celler i vev i livmorhalsen (Wang et al ., 2013; Hafiza og Latifah, 2014; Pariente et al., 2016). HeLa-kreftcellelinjen, hentet fra humane livmorhalskreftceller, er en vanlig cellulær modell for å evaluere det cytotoksiske potensialet av testforbindelser.Prostatakreft Er den nest ledende kreft hos menn over hele verden etter bronkuskreft, og den tredje vanligste årsaken til kreftdød. Det er den vanligste årsaken til malignitet hos menn. Forekomsten øker med alderen, mer vanlig over 50 år (Henry og Omahony, 1999; De-Bono et al., 2010; Wenbin et al., 2015). PC – 3 kreftcellelinjen, hentet fra mannlige prostatakreftceller, er en mye brukt modell for å undersøke toksisiteten av testforbindelser.Lungekreft Er en svært utbredt kreft blant menn i Usa siden midten av 1950-tallet og blant kvinner, siden slutten av 1980-tallet. Det er en ledende årsak til kreftrelatert død. Lungekreft skyldes for det meste røyking (Travis et al., 2002; Villanti et al., 2013; Jørgen et al., 2016). H460-kreftcellelinjen, hentet fra humane lungekreftceller (lymfogen metastatisk sublin av humant storcellet lungekarsinom), brukes ofte til å evaluere cytotoksisitet av testforbindelser.etter brystkreft, lunge og prostatakreft er tykktarmskreft den fjerde mest utbredte kreft over hele verden. Det er kreft som finnes i omtrent lik frekvens hos menn og kvinner. Det er den nest vanligste årsaken til kreftrelaterte dødsfall i vestlige land (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). Hct116 kreftcellelinjen, hentet fra humane kolonkreftceller, brukes ofte til å vurdere cytotoksisiteten til testforbindelser.
i fortsettelsen av våre studier på sopp transformasjon av bioaktive steroider (Choudhary et al., 2005b, c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017), syntetiserte vi analoger av drostanolon enanthate (1) gjennom sin transformasjon Med Cephalosporium aphidicola og Fusarium lini. Metabolitter 2-9, samt substrat 1, ble evaluert mot HeLa (cervikal karsinom), PC-3 (prostata karsinom), H460 (lungekreft), HCT116 (kolonkreft) og 3t3 (musfibroblast normal) cellelinjer, ved hjelp av cellebasert analyse med høy gjennomstrømning, den mest effektive og praktiske laboratoriemetoden, mtt-analysen for å forutsi responsen av testforbindelser i maligniteter der de viste spesifisitet mot kreftcellene. Denne studien har dermed identifisert anti-kreft metabolitter av drostanolon enanthate (1) for videre studier.
Materialer og Metoder
Instrumental Analyse
Tynnsjiktskromatografi (TLC) (silikagel, 20 × 20, 0,25 mm tykk, PF254, Merck, Tyskland) ble brukt til analyse av grad av transformasjon og renhet. Silikagel kolonnekromatografi (70-230 mesh, E. Merck, Tyskland) ble brukt til den første rensingen av metabolitter. I Tillegg ble preparativ omvendt fasegjenvinning (JAI LC-908w, Japan), utstyrt MED YMC L-80 (4-5 µ, 20-50 mm i.d.), brukt til endelig rensing av metabolitter. Strukturer av metabolitter ble belyst ved hjelp AV 1h- (400, 500 Og 600 MHz) og 13c-NMR (100, 125 Og 150 MHz) spektra, som ble registrert På Bruker AVANCE-NMR spektrometre (Frankrike) I CD3OD, CD3COCD3 eller DMSO-d6. HREI-MS og IR-spektra ble utført PÅ JEOL JMS – 600h (Japan) (dobbeltfokuserende magnetisk sektormasseanalysator) massespektrometer (EI, electron impact ionization) og Bruker Vector 22 FT-IR spektrofotometer, henholdsvis. Optiske rotasjoner av metabolitter ble registrert PÅ JASCO p-2000 polarimeter (Japan). Evolution 300 UV-synlig spektrofotometer ble brukt til å registrere UV-spektrene. Smeltepunktene til de transformerte produktene ble målt ved Hjelp Av buchi M-560 (Sveits) instrument. Røntgendiffraksjonsdata for enkeltkrystall ble samlet inn på Bruker APEXII D8 Venture-diffraktometer, utstyrt med FOTON 100-detektor (CMOS-Teknologi) og finfokus forseglet rør med Røntgenkilde (cu Ka-strålinger α = 1.54178 Å). Refleksjon intensiteter ble integrert VED HJELP AV SAINT software. Absorpsjon korreksjon ble gjort På Multi-scan, og strukturen ble løst AV SHELXTL program (Gerlier Og Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
Mikrobielle Kulturer
Mikrobiell kultur Av c. aphidicola ATCC 28300 Og F. lini NRRL 2204 ble oppnådd fra Henholdsvis American Type Culture Collection (Atcc) og Northern Regional Research Laboratories (NRRL). Kulturer ble dyrket På Sabouraud dextrose agar (SDA) skrå, og opprettholdt ved 4°C.
Media Forberedelse
Fire liter medier for vekst Av C. aphidicola ATCC – 28300 ble fremstilt ved å blande 200 g glukose, 4 G KH2PO4, 8 g glycin, 4 g KCl, 8 g MgSO4.7H2O og 8 mL sporstoffer i 4 L destillert vann. På samme måte ble fire liter medier fremstilt For F. lini NRRL 2204 ved å blande 40 g glukose, 20 g gjærekstrakt, 20 g pepton, 20 g KH2PO4, 20 g NaCl og 40 mL glyserol i 4 L destillert vann.
Gjæring Av Drostanolon Enanthate (1) Med c. aphidicola atcc 28300, Og F. lini NRRL 2204
Medium for vekst Av c. aphidicola Og F. lini ble fremstilt ved å blande ovennevnte ingredienser i 4 L destillert vann for hver sopp, som deretter ble dispensert likt i 40 erlenmeyer-kolber på 250 mL (100 mL i hver kolbe). Alle disse kolber ble autoklavert på 121°C, og ble inokulert MED SDA slants Av C. aphidicola ATCC 28300 Og F. lini NRRL 2204 under steriliserte forhold. Disse soppkulturene som inneholdt kolber ble etterlatt på roterende shaker (121 rpm) ved 26 ± 2°C i 3-4 dager for å oppnå maksimal vekst Av c. aphidicola og F. lini. Forbindelse 1 (1 g) ble oppløst i 20 mL aceton for hver sopp, og ble dispensert 0,5 mL i hver kolbe, og igjen plassert på roterende shaker i 12 dager. En negativ kontroll (medium + soppkultur), samt positiv kontroll (medium + substrat) ble også fremstilt analogt for å evaluere henholdsvis soppmetabolitter og nedbrytning av forbindelse 1. Etter inkubasjon av 12 dager, alle kolber ble filtrert og ekstrahert med 20 L diklormetan( DCM), organisk fase ble separert, og deretter ble fordampet under redusert trykk på roterende fordamperen. Dette ga 1,5 g blek gulaktig fast råolje. Dette råmaterialet ble fraksjonert over silikagelkolonnekromatografi ved eluering med gradientheksaner og acetonløsningsmiddelsystemer. Kolonnekromatografi ga fire hovedfraksjoner (1-4), som deretter ble renset ved gjenvinning AV HPLC. Metabolitter 2 (tR = 16 min, 8 mg, 0,8%), 3 (tR = 19 min, 11 mg, 1,1%), 4 (tR = 17 min, 35 mg, 3,5%), 5 (tR = 23 min, 42 mg, 4,2%), 6 (tR = 20 min, 9 mg, 0,9%), 7 (tR = 21 min, 12 mg, 1,2%) og 9 (tR = 18 min, 5 mg, 0,5%) ble renset fra fraksjoner 1-7, henholdsvis gjennom omvendt fase resirkulering hplc ved hjelp av metanol – vann som løsemiddel system (meoh: h2o; 70: 30). Mens metabolitt 8 ble oppnådd fra fraksjon 8 gjennom normal fasegjenvinning HPLC (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0,75%).
2α-Metyl-3α,14α,17β-trihydroksy-5α-androstan (2)
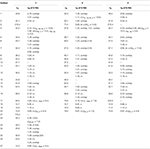
Tabell 1. 13c-og 1h-NMR kjemiske skiftdata (J Og W1 / 2 I Hz) av forbindelser 1-3 (δ ppm).
2α-Methyl-7α-hydroxy-5α-androstan-3, 17-dione (3)
2α-Methyl-3α,17β-dihydroxy-5α-androstane (4)
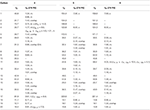
Tabell 2. 13c-og 1h-NMR kjemiske skiftdata (J Og W1 / 2 I Hz) av forbindelser 4-6 (δ ppm).
2-Metylandrosta-1,4-dien-3,17-dion (5)
2-Metylandrosta-11α-hydroksy-1,4-dien-3,17-dion (6)
2-Metylandrosta-14α-hydroksy-1,4-dien-3,17-dion (7)
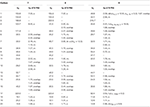
tabell 3. 13c-og 1h-NMR kjemiske skiftdata (J Og W1 / 2 I Hz) av forbindelser 7-9 (δ ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Cellelinjer ble dyrket i DMEM F12 media, supplert med 10% FBS under en 5% CO2-atmosfære ved 37°C i en inkubator.
den kolorimetriske analysen MTT ble brukt til evaluering av cellemetabolsk aktivitet. I denne analysen reduseres den gule MTT til lilla formazon i mitokondriene til levende celler(Gerlier Og Thomasset, 1986). Jo mer levende celler, desto mer farge og dermed mer absorbans observeres av kolorimeter (Fesahat et al., 2015). Vi har brukt denne metoden for å analysere effekten av våre transformerte produkter på cellulær cytotoksisitet mot kreftceller. Rundt 10.000 celler av hver cellelinje (HeLa, PC3, H460, HCT116 kreft og 3t3 normal) ble sådd i 96-brønnplater. Etter å ha nådd 80-90% konfluens ble de behandlet med forskjellige konsentrasjoner av forbindelser (25, 50, 75, 100 og 200 µ) i 24 timer. Alle forbindelser ble oppløst i steril DMSO for å lage en 200 mM lageroppløsning. Løsningen ble filtrert, og serielle fortynninger ble gjort i vekstmedium. 600 µ av hver fortynning ble brukt til å behandle 3 brønner (tre eksemplarer av hver) på 96 brønnplater, dvs. 200 µ hver. Hvert forsøk ble utført i tre biologiske replikater. MTT ble tilsatt og inkubert i 4 timer. Etter fjerning AV MTT ble de lilla formazonkrystallene oppløst i DMSO, og lesing ble observert ved henholdsvis 540 og 570 nm for henholdsvis normale og kreftceller. Multiskan-leseren gir ④max ved 540 nm I DMSO-behandlede 3t3 fibroblastceller (som er mer konfluente i morfologi), mens 570 nm gir λ (Bonmati-Carrion et al., 2013; Danihelová et al., 2013). Et bredt spekter av epitelkarsinomcellelinjer ble brukt i dette eksperimentet hvor cisplatin var et vanlig stoff av valg. DET retter SEG MOT DNA, forstyrrer celledeling under mitose og induserer apoptose (Eastman, 1999). IC50-verdier ble beregnet for å bestemme minimumskonsentrasjonen som kreves for å drepe 50% av cellene.
Mens
At = Absorbansverdi av testforbindelsen
Ab = Absorbansverdi av blank
Ac = Absorbansverdi av kontroll
Resultater og Diskusjon
struktur elucidation
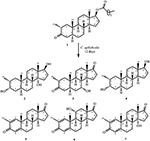
figur 1. Biotransformasjon av drostanolon enanthate (1) Med Cefalosporium aphidicola.
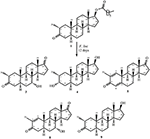
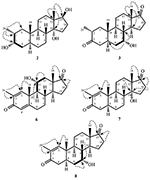
Figur 2. Biotransformasjon av drostanolon enanthate (1) Med Fusarium lini.Metabolitt 2 ble isolert som hvite krystaller. Molekylformelen C20H30O3 var basert PÅ HREI-MS som viste at m / z 322.2517 (calcd. 322.2508, C20H34O3), som tyder på tilsetning av tre hydrogen og et oksygenatom, reduksjon Av c-3 ketonisk karbonyl og hydrolytisk spaltning av heptanoat sidekjede i substrat 1. IR-absorbansen ved 3531 og 3423 cm-1 skyldtes tilstedeværelse av hydroksylgrupper. 1h-NMR-spekteret viste et ekstra metinprotonsignal ved δ 3,69 (Tabell 1) (datablad 2). Signalene for heptanoat sidekjede ble også funnet mangler I 1H-NMR spektrum av forbindelse 2. 13c-NMR-spekteret viste signaler for nytt metinkarbon ved δ 71,4, og nytt kvartært karbon ved δ 84,8. Karbonsignaler for heptanoatkjede og ketonisk karbonyl ble også funnet mangler I 13c-NMR spektrum. Dette foreslo reduksjon Av c-3 karbonyl, hydrolytisk tap av heptanoatkjede og tilsetning AV EN OH Ved C-14 (Tabell 1). OH-gruppen ble plassert På C-3 på GRUNNLAG Av HMBC-korrelasjoner Av H3-20 (δ 0.91, d) Med C-3 (δ 71.4) (Figur 3). Dette skyldes reduksjonen Av c-3 karbonyl. Andre OH-gruppe ble plassert Til C-14, basert på HMBC-korrelasjonen Mellom H3-18 (δ 0.81, s) Og C-14 (δ 84.8). Den tredje OH var På C-17, skyldes hydrolytisk tap av heptanoatdelen. O-H-gruppen ved C-3 ble utledet til å være α-orientert basert På NOESY korrelasjoner Av H-3 (δ 3.69, br. s) med β-orientert H-2 (δ 1.64, overlapping), og α-orientert H3-20 (δ 0.91, d) (Figur 4). Oh-14 ble utledet til å være α-orientert, basert På NOYY korrelasjoner av H-9 (δ 1.32, m) med OH-14 (δ 2.66, s) (aceton-d6). Røntgendiffraksjonsanalyse med enkeltkrystall støttet videre strukturen til metabolitt 2, bestående av tre ringer i stolkonformasjon (A, B og C), og en i innhyllingskonformasjon (D). Tre OH-grupper På C-3, C-14 og C-17 ble tildelt, α-, α-og β (Figur 5). Enkeltkrystalldiffraksjonsdata for metabolitt 2 ble sendt Til Cambridge Crystallographic Data Collection (CCDC 1500706). Strukturen til metabolitt 2 ble dermed utledet som 2α-metyl-3α,14α,17β-trihydroksy-5α-androstan.
Figur 3. NØKKEL HMBC ( ), OG COSY (
), OG COSY ( ) korrelasjoner i nye metabolitter.
) korrelasjoner i nye metabolitter.
Figur 4. Nøkkel NOESY korrelasjoner i nye metabolitter.
Metabolitt 3 ble oppnådd som et hvitt fast stoff. HREI-MS viste at m/z 318.2192 (calcd. 318.2195, C20H30O3). Dette representerte tap av heptanoat sidekjede, og tilsetning av et oksygenatom i substrat 1. IR-spektrum viste absorbanser FOR OH (3,436 cm-1) og ketoniske karbonyler (1,711 cm−1). I 1h-NMR-spekteret ble det funnet mangler av heptanoatkjede og C-17 metinproton, mens et nytt nedfelt metinprotonsignal ble observert ved δ 3,92 (Tabell 1) (datablad 3). Dette foreslo hydroksylering av steroide skjelett og oksidativ spaltning av heptanoatdelen. 13c-NMR-spekteret støttet også de ovennevnte avledninger. Karbonsignaler for heptanoatdelen ble funnet mangler, mens en ny ketonisk karbonyl og en oxy-metin signaler dukket opp I 13c-NMR spektrum (Tabell 1). Dette indikerte oksidativ spaltning av heptanoatkjede og hydroksylering i substrat 1. Det nylig viste metinprotonet ved δ 3.92 (H-7) viste HMBC-korrelasjoner Med C-5 og C-8, noe som tyder PÅ EN OH Ved C-7 (Figur 3). HMBC-korrelasjonene Mellom H3 – 18 Og H2-16 med et karbon ved δ 223,8 foreslo et ketonisk karbon Ved C-17. OH Ved C-7 ble ytterligere støttet av KOSELIGE korrelasjoner Av H-7 Med H2-6 og H-8. H-7 (δ 3.92, s) viste NOESY korrelasjoner med aksialt orientert H-8 (δ 1.70, overlapping), som foreslo EN α-orientering AV OH ved C-7 (Figur 4). Strukturen av metabolitt 3 ble således utledet som 2α-metyl-7α-hydroksy-5α-androstan-3,17-dion.
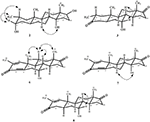
Enkeltkrystallrøntgendiffraksjonsanalyser ble også utført på forbindelser 1 og 5. Sammensatt 1 besto av fire ringer, Dvs. A, B, C og D med stol, stol, stol og konvoluttkonformasjoner. En metyl var tilstede Ved C-2 med ekvatorial orientering. Heptanoat ester kjede var tilstede Ved c-17 av ring D (Figur 6). Metabolitt 5 inneholder ringene a, B, C og D i høvel -, stol -, stol-og innhyllingskonformasjoner. Heptanoat sidekjeden var fraværende i metabolitt 5 (Figur 7). Enkeltkrystalldiffraksjonsdata for metabolitter 1 og 5 ble sendt til Cambridge Krystallografisk Datainnsamling (HENHOLDSVIS CCDC 1500705 og CCDC 1500707). Røntgendiffraksjonsanalysedata for enkeltkrystall 1, 2 og 5 er presentert i Tabell 4.
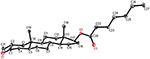
Figur 6. Datagenerert ORTEP tegning av endelige X-ray modell av sammensatte 1. Fargekoder: karbon, svart; oksygen, rød.
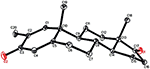
Figur 7. Datagenerert ORTEP tegning av endelige X-ray modell av sammensatte 5. Fargekoder: karbon, svart; oksygen, rød.

Tabell 4. Enkeltkrystallrøntgendiffraksjonsanalyse av forbindelser 1, 2 og 5.
Cytotoksisitet Mot HeLa, PC3, H640 Og HCT116 Kreft, OG 3T3 Normale Cellelinjer
Naturlige produkter, f.eks flavonoider, steroider, terpener, etc. kan tjene som en utmerket kilde for produksjon av mange stoffer, som de er rapportert for mange biologiske aktiviteter som anti-kreft, anti-inflammatorisk, anti-leishmanial, anti-bakterielle aktiviteter, etc. Derfor er det nødvendig å derivatisere dem, for å studere struktur-aktivitetsforhold som kan være nyttig for syntese av sikre og effektive stoffer. For tiden syntetiseres mange farmasøytiske produkter effektivt via mikrobiell biotransformasjon på grunn av tilstedeværelse av en rekke enzymer i dem. Basert på rapportert anti-kreftaktivitet av drostanolon (9), drostanolonpropionat og drostanolonheptanoat (1), ble forbindelser 1-9 evaluert for cytotoksisitet mot HeLa, PC-3, H460 og HCT116 kreftcellelinjer. Interessant, alle forbindelser viste en moderat til potent anti-kreft aktivitet. Antikreftaktiviteten til forbindelser 1-9 ble utledet fra IC50-verdiene mot HeLa (humant livmorhalskreft), PC-3 (human prostatakreft), H460 (human lungekreft) og HCT116 (human tykktarmskreft) (Tabell 5). Basert på disse resultatene ble cytotoksisiteten av disse forbindelsene også evaluert mot 3t3 (musefibroblast) normal cellelinje, der alle forbindelser, unntatt 8 (IC50 = 74.6 ± 3.7 µ) og 9 (IC50 = 62.1 ± 1.2 µ), ble funnet å være ikke-cytotoksiske.

Tabell 5. Cytotoksisitet av forbindelser 1-9 mot hela, PC3, H460 og HCT116 kreft, OG 3t3 normale cellelinjer.
Struktur-Aktivitet Forhold
Variasjoner i strukturer av metabolitter påvirket deres anti-kreft aktivitet. Metabolitt 2 med fravær av esterdel, og to ao-H-grupper Ved C-3 og C-14, og en ß-h-gruppe ved C-17 viste lavere cytotoksisitet mot HeLa, H460 og HCT116 kreftcellelinjer, men dens anti-kreftaktivitet var høyere mot PC-3 kreftcellelinje, sammenlignet med forbindelse 1. Metabolitt 3 med tap av estergruppe og to ketogrupper Ved C-3 Og C-17 og aO-H-gruppen ved C-7 viste også lavere aktivitet mot HeLa, H460 og HCT116 kreftcellelinjer, men økt aktivitet mot PC – 3 kreftcellelinje sammenlignet med substrat 1. Reduksjon Av c-3 karbonyl Til O-H og hydrolytisk spaltning av esterdelen i forbindelse 4 økte sin aktivitet mot Både HeLa og PC-3 kreftcellelinjer til en viss grad, men dens anti-kreftaktivitet mot H460 og HCT116 kreftcellelinjer ble redusert sammenlignet med substrat 1. Tilstedeværelse Av C = C mellom C-1 / C-2 og C-4 / C-5, sammen Med c = O Ved C-3, og C-17 gjorde metabolitt 5 til et potent anti-kreftmiddel mot HeLa kreftcellelinje, sammenlignet med substrat 1 og standardmedikamentet (cisplatin). Dess, sin anti-kreft aktivitet mot PC-3 kreftcellelinjen ble også økt i forhold til substrat 1. Interessant, sin anti-kreft aktivitet mot H460, OG HCT116 kreftcellelinjer var lavere i forhold til sammensatte 1. Tilstedeværelse Av C = C Mellom C-1 / C-2 og C-4 / C-5, C = O Ved C-3 og C-17, sammen med ao-h-gruppen Ved c-11 i metabolitt 6 økte sin anti-kreft aktivitet mot HeLa, OG PC-3 kreftcellelinjer i forhold til substrat 1 og viste lignende anti-kreft potensial mot HeLa kreftcellelinje som standard legemiddel (cisplatin). Imidlertid er dens anti-kreft aktivitet mot H460, OG HCT116 kreftcellelinjer redusert i forhold til sammensatte 1. Tilstedeværelse Av C = C Mellom C-1 / C-2 og C-4 / C-5, C = O Ved C-3 og C-17, sammen med ao-h-gruppen Ved c-14 i metabolitt 7 økte igjen sin anti-kreftaktivitet mot HeLa og PC-3 kreftcellelinjer, og reduserte sin anti-kreftaktivitet mot H460 og HCT116 cellelinjer sammenlignet med substrat 1. Tilstedeværelse Av C = C Ved C-1 / C-2, C = O Ved C-3 og C-17, og aOH Ved C-7 gjorde metabolitt 8 til den mest potente anti-kreft mot HeLa kreftcellelinje i forhold til substrat 1 og standardmedikamentet (cisplatin). Det viste også en god aktivitet mot PC – 3 kreftcellelinje, men reduserte anti-kreftaktiviteten mot H460 og HCT116 kreftcellelinjer sammenlignet med substrat 1. Metabolitt 9 med bare hydrolyse Ved C-17 viste økt anti-kreftaktivitet mot HeLa, PC-3 og hct116 kreftcellelinjer, men reduserte cytotoksisitet mot H460 kreftcellelinje sammenlignet med substrat 1 og standardmedikamentet (cisplatin). På grunnlag av ovennevnte diskusjon kan det konkluderes med at økt anti-kreft aktivitet av forbindelser 5-8 mot HeLa, OG PC-3 kreftcellelinjer var sannsynligvis på grunn Av tilstedeværelsen Av C = C Ved C-1 / C-2, og karbonylketon Ved C-3, Og C-17 i forhold til substrat 1.
Konklusjon
Forfatterbidrag
konseptet med presentert forskning ble utviklet og designet av MIC. MIC var også prosjektleder. Alle dataene ble analysert og tolket AV MIC, a-t-W og HC. MS, SY, MA og NF utførte forsøkene. MIC, A-T-W og MS skrev manuskriptet. Alle forfatterne reviderte manuskriptet. Den endelige versjonen av manuskriptet ble også godkjent av MIC før innlevering.
Interessekonflikt
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Bekreftelser
A-t-W, og MIC anerkjenner den muliggjørende rollen Til Higher Education Commission, Islamabad, Pakistan, gjennom en økonomisk støtte under, » Studier På Chemoprevention Av Mammary Carcinogenesis By Dietary Agents, (20-3790/NRPU / R &D/HEC/13/793).»SY anerkjenner den økonomiske støtten TIL OPCW (Organisasjonen for Forbud Mot Kjemiske Våpen) gjennom et forskningsprosjekt med tittelen» Strukturelle og biologiske studier på nye anabole steroider oppnådd av biotransformasjon.»HC anerkjenner den økonomiske støtten til» Deanship Of Scientific Research( DSR), King Abdulaziz University, Utdanningsdepartementet, Saudi-Arabia.»
Supplerende Materiale
Eastman, A. (1999). «Virkningsmekanismen av cisplatin: fra adducts til apoptose,» I Cisplatin: Kjemi og Biokjemi Av Et Ledende Anticancer Stoff, ed B. Lippert (Zü: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002 / 9783906390420. ch4
CrossRef Full Text | Google Scholar
Vardar, E., Vardar, S. A. og Cengiz, T. (2002). Anabole-androgene steroider misbruk. Anato. J. Psykiatri 3, 104-107.