- Introducere
- materiale și metode
- analiza instrumentală
- culturi microbiene
- prepararea mediilor
- fermentarea enantatului de Drostanolonă (1) cu C. aphidicola ATCC 28300 și F. lini NRRL 2204
- 2 XlX-metil-3 XlX,14 XlX,17 XlX-trihidroxi-5 XlX-androstan (2)
- 2α-Metil-7α-hidroxi-5α-androstan-3,17-dionă (3)
- 2α-Metil-3α,17β-dihidroxi-5α-androstan (4)
- 2-Metilandrosta-1,4-dien-3,17-dionă (5)
- 2-Metilandrosta-11-hidroxi-1,4-dien-3,17-dionă (6)
- 2-Metilandrosta-14-hidroxi-1,4-dien-3,17-dionă (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- rezultate și discuții
- elucidarea structurii
- citotoxicitatea împotriva cancerului HeLa, PC3, H640 și HCT116 și a liniilor celulare normale 3T3
- relația structură-activitate
- concluzie
- contribuții autor
- Declarație privind conflictul de interese
- mulțumiri
- material suplimentar
Introducere
transformarea microbiană este una dintre cele mai importante abordări pentru transformarea structurală a diferitelor clase de compuși organici. Această tehnică a fost utilizată cu succes în chimia verde, adică. descoperirea de droguri și programe de dezvoltare, oferind o sursă excelentă de compuși în jurul structurilor de bază, urmată de screening pentru diverse activități biologice. În mai multe cazuri, transformarea microbiană a fost utilizată ca un instrument important pentru conversiile regio-, chemo-și stereo-selective ale compușilor organici care sunt dificil de realizat prin metode convenționale (Holland și Weber, 2000; Fernandes și colab., 2003; Mihovilovic și colab., 2003; Yildirim și colab., 2003; Bartmanska și colab., 2005; Borges și colab., 2009; Choudhary și colab., 2011; Ravindran și colab., 2012). Datorită naturii inactive a scheletului de hidrocarburi al steroizilor, acestea sunt adesea dificil de derivat prin metode sintetice convenționale. Prin urmare, transformarea microbiană este adesea utilizată pentru modificarea structurală a steroizilor. Prezența sistemelor enzimatice ale citocromului P450 în ciuperci face ca biocataliza cu celule întregi să fie un instrument eficient pentru hidroxilarea stereo și Regio-specifică (Choudhary și colab., 2005a; Tong și Dong, 2009; Kristan și Ri Unixtner, 2012; Baydoun și colab., 2014).Drostanolone, și derivații săi esteri, cum ar fi Drostanolone Propionat, Drostanolone pentanoat, și Drostanolone enanthate (1) sunt steroizi anabolizanți-androgenice (AASs) utilizate de sportivi pentru a consolida muschii lor, fără a obține grăsime. În plus, drostanolona și derivații săi de esteri au capacitatea de a inhiba producția de estrogen. Esterul propionat al drostanolonei este, de asemenea, utilizat pentru tratamentul cancerului de sân, sub numele de marcă Masteron (Chowdhury și colab., 1976; Clavel și colab., 1982; Marinov și colab., 1986; Vardar și colab., 2002; Bahrke și Yesalis, 2004).
cancerul este în prezent recunoscut ca o provocare majoră de sănătate publică. Cancerul este a doua cauză principală de deces în Statele Unite și în întreaga lume. Potrivit Organizației Mondiale a Sănătății (OMS), prevalența cancerului depășește 6 milioane de cazuri pe an. Celulele canceroase au o rată mare de proliferare. Ei se răspândesc rapid în sistemul viu și pot supraviețui împotriva chimioterapiei puternice și a agenților care dăunează ADN-ului. În mod similar, medicamentele citotoxice au multe efecte adverse asupra celulelor normale și, prin urmare, utilizarea lor în chimioterapia cancerului este o provocare terapeutică. Datorită acestui fapt, este necesară urgent dezvoltarea agenților chimioterapeutici siguri, eficienți și selectivi împotriva diferitelor tipuri de cancer (Munoz-Pinedo și colab., 2012; Su și colab., 2015; Swadogo și colab., 2015; Rebecca și colab., 2016).
cancerul de sân este unul dintre cele mai frecvente tipuri de cancer din 140 de țări ale lumii. Este o cauză majoră a decesului legat de cancer la femeile din întreaga lume, caracterizată prin creșterea anormală a celulelor din lobulii sau canalele mamare cu rata mare de proliferare (Hanahan și Weinberg, 2000; Ferlay și colab., 2015).
cancerul de col uterin este al doilea cel mai predominant cancer la femei din întreaga lume, după cancerul de sân. Principala cauză a cancerului de col uterin este formarea de celule maligne în țesuturile colului uterin (Wang și colab., 2013; Hafiza și Latifah, 2014; Pariente și colab., 2016). Linia celulară de cancer hela, obținută din celulele canceroase umane de col uterin, este un model celular comun pentru a evalua potențialul citotoxic al compușilor testați.
cancerul de prostată este al doilea cancer principal la bărbați la nivel mondial după cancerul bronhic și a treia cauză cea mai frecventă de deces prin cancer. Este cel mai frecvent motiv de malignitate la bărbați. Incidența sa crește odată cu vârsta, mai frecventă la vârsta de 50 de ani (Henry și Omahony, 1999; de-Bono și colab., 2010; Wenbin și colab., 2015). Linia celulară de cancer PC-3, obținută din celulele canceroase de prostată masculine, este un model utilizat pe scară largă pentru a investiga toxicitatea compușilor testați.
cancerul pulmonar este un cancer foarte răspândit în rândul bărbaților din Statele Unite de la mijlocul anilor 1950 și în rândul femeilor, de la sfârșitul anilor 1980. este o cauză principală a decesului legat de cancer. Cancerul pulmonar este în mare parte atribuit fumatului (Travis și colab., 2002; Villanti și colab., 2013; Mishra și colab., 2016). Linia celulară de cancer h460, obținută din celulele cancerului pulmonar uman (sublina metastatică limfogenă a carcinomului pulmonar cu celule mari umane), este adesea utilizată pentru a evalua citotoxicitatea compușilor testați.după cancerul de sân, plămân și prostată, cancerul de colon este al patrulea cel mai răspândit cancer din întreaga lume. Este cancerul găsit în frecvență aproximativ egală la bărbați și femei. Este a doua cauză cea mai frecventă a deceselor legate de cancer în țările occidentale (Levin și colab., 2008; Andre și colab., 2009; Ahearn și colab., 2012). Linia de celule canceroase HCT116, obținută din celulele cancerului de colon uman, este utilizată în mod obișnuit pentru a evalua citotoxicitatea compușilor testați.
în continuarea studiilor noastre privind transformarea fungică a steroizilor bioactivi (Choudhary și colab., 2005b, c, 2007, 2010; Ahmad și colab., 2014; Siddiqui și colab., 2017), am sintetizat analogi ai Drostanolone enanthate (1) prin transformarea sa cu Cefalosporium aphidicola și Fusarium lini. Metaboliții 2-9, precum și substratul 1, au fost evaluați împotriva liniilor celulare hela (carcinom de col uterin), PC-3 (carcinom de prostată), H460 (cancer pulmonar), HCT116 (cancer de colon) și 3T3 (fibroblast normal de șoarece), utilizând testul pe bază de celule cu randament ridicat, cea mai eficientă și convenabilă metodă de laborator, testul MTT pentru a prezice răspunsul compușilor testați în afecțiuni maligne, unde au prezentat specificitate împotriva celulelor canceroase. Acest studiu a identificat astfel metaboliții anti-cancer ai Drostanolone enanthate (1) pentru studii suplimentare.
materiale și metode
analiza instrumentală
cromatografia în strat subțire (TLC) (silicagel, 20 20, 0,25 mm grosime, PF254, Merck, Germania) a fost utilizată pentru analiza gradului de transformare și puritate. Cromatografia coloanei de silicagel (70-230 mesh, E. Merck, Germania) a fost utilizată pentru purificarea inițială a metaboliților. În plus, pentru purificarea finală a metaboliților a fost utilizată reciclarea preparativă în fază inversă (JAI LC-908w, Japonia), echipată cu YMC L-80 (4-5 mm, 20-50 mm I.d.). Structurile metaboliților au fost elucidate cu ajutorul spectrelor 1h-(400, 500 și 600 MHz) și 13C-RMN (100, 125 și 150 MHz), care au fost înregistrate pe spectrometrele Bruker Avance-RMN (Franța) în CD3OD, CD3COCD3 sau DMSO-d6. Spectrele HREI-MS și IR au fost efectuate pe spectrometru de masă JEOL JMS-600h (Japonia) (analizor de masă cu Sector magnetic cu focalizare dublă) (EI, ionizare cu impact electronic) și respectiv spectrofotometru Bruker Vector 22 FT-IR. Rotațiile optice ale metaboliților au fost înregistrate pe polarimetrul JASCO P-2000 (Japonia). Spectrofotometrul vizibil UV Evolution 300 a fost utilizat pentru înregistrarea spectrelor UV. Punctele de topire ale produselor transformate au fost măsurate cu ajutorul instrumentului Buchi M-560 (Elveția). Datele de difracție cu raze X monocristaline au fost colectate pe difractometrul Bruker APEXII D8 Venture, dotat cu detector PHOTON 100 (tehnologie CMOS) și tub etanșat cu focalizare fină având sursă de raze X (radiații cu KA xult = 1.54178 Int). Intensitățile de reflecție au fost integrate folosind software-ul SAINT. Corecția de absorbție a fost făcută pe Multi-scanare, iar structura a fost rezolvată de programul SHELXTL (Gerlier și Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
culturi microbiene
cultura microbiană a C. aphidicola ATCC 28300 și F. lini NRRL 2204 au fost obținute de la American type Culture Collection (ATCC) și, respectiv, de la Northern Regional Research Laboratories (NRRL). Culturile au fost cultivate pe Sabouraud dextroză agar (SDA) înclinat, și menținut la 4 centimetrii C.
prepararea mediilor
patru litri de medii pentru creșterea C. aphidicola ATCC-28300 a fost preparat prin amestecarea a 200 g de glucoză, 4 g de KH2PO4, 8 g de glicină, 4 g de KCl, 8 g de MgSO4.7h2o și 8 mL de oligoelemente în 4 L de apă distilată. În mod similar, patru litri de mediu au fost pregătiți pentru F. lini NRRL 2204 prin amestecarea a 40 g de glucoză, 20 g de extract de drojdie, 20 g de peptonă, 20 g de KH2PO4, 20 g de NaCI și 40 mL de glicerol în 4 L de apă distilată.
fermentarea enantatului de Drostanolonă (1) cu C. aphidicola ATCC 28300 și F. lini NRRL 2204
mediu pentru creșterea C. aphidicola și F. lini a fost preparat prin amestecarea ingredientelor menționate mai sus în 4 L de apă distilată pentru fiecare ciupercă, care a fost apoi distribuită în mod egal în 40 de flacoane Erlenmeyer de 250 mL (100 mL în fiecare balon). Toate aceste flacoane au fost autoclavizate la 121 CTC și au fost inoculate cu oblice SDA de C. aphidicola ATCC 28300 și F. lini NRRL 2204 în condiții sterilizate. Aceste culturi fungice care conțineau flacoane au fost lăsate pe agitatorul rotativ (121 rpm) la 26 octombrie 2 octombrie C timp de 3-4 zile pentru a obține creșterea maximă a C. aphidicola și F. lini. Compusul 1 (1 g) a fost dizolvat în 20 mL de acetonă pentru fiecare ciupercă și a fost distribuit 0,5 mL în fiecare balon și plasat din nou pe agitator rotativ timp de 12 zile. Un control negativ (mediu + cultură fungică), precum și un control pozitiv (mediu + substrat) au fost, de asemenea, preparate în mod analog pentru a evalua metaboliții fungici și, respectiv, degradarea compusului 1. După incubarea a 12 zile, toate baloanele au fost filtrate și extrase cu 20 L de diclormetan (DCM), faza organică a fost separată și apoi evaporată sub presiune redusă pe evaporatorul Rotativ. Aceasta a dat 1,5 g de brut solid gălbui PAL. Acest material brut a fost fracționat peste cromatografia coloanei de silicagel prin eluție cu hexani cu gradient și sisteme de solvent cu acetonă. Cromatografia pe coloană a produs patru fracții principale (1-4), care au fost apoi purificate prin reciclarea HPLC. Metaboliții 2 (tR = 16 min, 8 mg, 0,8%), 3 (tR = 19 min, 11 mg, 1,1%), 4 (tR = 17 min, 35 mg, 3,5%), 5 (tR = 23 min, 42 mg, 4,2%), 6 (tR = 20 min, 9 mg, 0,9%), 7 (tR = 21 min, 12 mg, 1,2%) și 9 (tR = 18 min, 5 mg, 0,5%) au fost purificați din fracțiile 1-7, respectiv, prin faza inversă de reciclare HPLC folosind metanol – apă ca sistem solvent (meoh: H2O; 70: 30). Întrucât, metabolitul 8 a fost obținut din fracțiunea 8 prin reciclarea în fază normală a HPLC (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0,75%).
2 XlX-metil-3 XlX,14 XlX,17 XlX-trihidroxi-5 XlX-androstan (2)
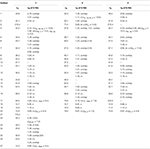
Tabelul 1. 13C-și 1H-RMN date de deplasare chimică (J și W1/2 în Hz) ale compușilor 1-3 (ppm de la sută).
2α-Metil-7α-hidroxi-5α-androstan-3,17-dionă (3)
2α-Metil-3α,17β-dihidroxi-5α-androstan (4)
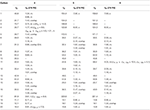
Tabelul 2. 13C-și 1H-RMN date de deplasare chimică (J și W1/2 în Hz) ale compușilor 4-6 (ppm de la sută).
2-Metilandrosta-1,4-dien-3,17-dionă (5)
2-Metilandrosta-11-hidroxi-1,4-dien-3,17-dionă (6)
2-Metilandrosta-14-hidroxi-1,4-dien-3,17-dionă (7)
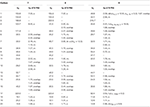
tabelul 3. Date de deplasare chimică 13C și 1H-RMN (J și W1/2 în Hz) ale compușilor 7-9 (ppm de la 7 la 9).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Liniile celulare au fost cultivate în medii DMEM F12, suplimentate cu 10% FBS sub o atmosferă de 5% CO2 la 37 centicc într-un incubator.
testul colorimetric MTT a fost utilizat pentru evaluarea activității metabolice celulare. În acest test, MTT galben este redus la formazon purpuriu în mitocondriile celulelor vii (Gerlier și Thomasset, 1986). Cu cât sunt mai multe celule vii, cu atât culoarea și, prin urmare, mai multă absorbție sunt observate de colorimetru (Fesahat și colab., 2015). Am folosit această metodă pentru a analiza efectul produselor noastre transformate asupra citotoxicității celulare împotriva celulelor canceroase. Aproximativ 10.000 de celule din fiecare linie celulară (cancerele HeLa, PC3, H460, HCT116 și 3T3 normal) au fost însămânțate în plăci cu 96 de puțuri. După atingerea confluenței de 80-90%, aceștia au fost tratați cu diferite concentrații de compuși (25, 50, 75, 100 și 200 mm) timp de 24 h. toți compușii au fost dizolvați în DMSO steril pentru a obține o soluție stoc de 200 mM. Soluția a fost filtrată, iar diluțiile seriale au fost făcute în mediu de creștere. S-a utilizat un număr de 600 unkticli din fiecare diluție pentru tratarea a 3 godeuri (trei exemplare din fiecare) de 96 de plăci de sondă, adică 200 unkticli fiecare. Fiecare experiment a fost efectuat în trei replici biologice. MTT a fost adăugat și incubat timp de 4 ore. după îndepărtarea MTT, cristalele formazon violet au fost dizolvate în DMSO, iar citirea a fost observată la 540 și 570 nm pentru celulele normale și, respectiv, canceroase. Cititorul multiskan dă la 540 nm în celulele fibroblaste 3T3 tratate cu DMSO (care sunt mai confluente în morfologie), în timp ce în cazul celulelor canceroase, 570 nm dă la 570 nm (Bonmati-Carrion și colab., 2013; Danihelov si colab., 2013). O gamă largă de linii celulare de carcinom epitelial au fost utilizate în acest experiment în care cisplatina a fost un medicament comun de alegere. Acesta vizează ADN-ul, interferează cu diviziunea celulară în timpul mitozei și induce apoptoza (Eastman, 1999). Valorile IC50 au fost calculate pentru a determina concentrația minimă necesară pentru a ucide 50% din celule.
întrucât,
At = valoarea absorbanței compusului testat
Ab = valoarea absorbanței martor
Ac = valoarea absorbanței martor
rezultate și discuții
elucidarea structurii
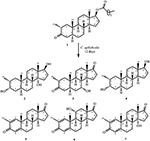
figura 1. Biotransformarea enantatului de drostanolonă (1) cu Cefalosporium aphidicola.
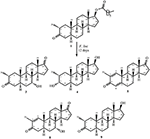
Figura 2. Biotransformarea enantatului de drostanolonă (1) cu Fusarium lini.
metabolitul 2 a fost izolat sub formă de cristale albe. Formula moleculară C20H30O3 s-a bazat pe HREI-MS care a arătat at m/z 322.2517 (calcd. 322.2508, C20H34O3), sugerând adăugarea a trei hidrogen și a unui atom de oxigen, reducerea carbonilului cetonic C-3 și scindarea hidrolitică a lanțului lateral heptanoat în substratul 1. Absorbanța IR la 3.531 și 3.423 cm-1 s-au datorat prezenței grupărilor hidroxil. Spectrul 1H-RMN a prezentat un semnal suplimentar de protoni metinici la 3.69 (tabelul 1) (fișa tehnică 2). Semnalele pentru lanțul lateral heptanoat au fost, de asemenea, găsite lipsă în spectrul 1H-RMN al compusului 2. Spectrul 13C-RMN a arătat semnale pentru un nou carbon metinic la 71.4 de la hectar și un nou carbon cuaternar la 84.8 de la hectar. Semnalele de Carbon pentru lanțul heptanoat și carbonilul cetonic au fost, de asemenea, găsite lipsă în spectrul 13C-RMN. Aceasta a sugerat reducerea carbonilului C-3, pierderea hidrolitică a lanțului heptanoat și adăugarea unui OH La C-14 (Tabelul 1). Grupul OH a fost plasat la C-3 pe baza corelațiilor HMBC ale H3-20 (0.91, D) cu C-3 (71.4) (figura 3). Acest lucru a rezultat din reducerea carbonilului C-3. Al doilea grup OH a fost plasat la C-14, pe baza corelației HMBC a H3-18 (0,81, s) cu C-14 (84,8). Al treilea OH a fost la C-17, rezultat din pierderea hidrolitică a fragmentului de heptanoat. Grupul O-H de la C – 3 a fost dedus ca fiind orientat pe baza corelațiilor NOESY ale lui H-3 (3.69, br. s) cu H-2 orientat spre x-x (x-x 1.64, suprapunere) și H3-20 orientat spre x-x (x-x 0.91, d) (Figura 4). OH-14 S-a dedus ca fiind orientat spre sec, pe baza corelațiilor NOESY ale lui H-9 (1,32, m) cu OH-14 (2,66, s) (acetonă-d6). Analiza difracției cu raze X cu un singur cristal a susținut în continuare structura metabolitului 2, format din trei inele în conformația scaunului (a, b și C) și unul în conformația învelișului (D). Trei grupări OH de la C-3, C-14, C-17 au fost atribuite, α, α-și β-orientare (Figura 5). Datele de difracție monocistalină ale metabolitului 2 au fost trimise la Cambridge Crystallographic Data Collection (CCDC 1500706). Structura metabolitului 2 a fost astfel dedusă ca 2-3-3, 14, 17-trihidroxi-5-androstan.
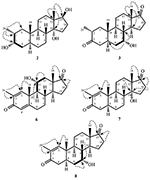
Figura 3. HMBC cheie ( ), și confortabil (
), și confortabil ( ) corelații în noi metaboliți.
) corelații în noi metaboliți.
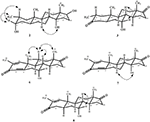
Figura 4. Corelații NOESY cheie în noi metaboliți.
metabolitul 3 a fost obținut sub formă de solid alb. HREI-MS a afișat at M / z 318.2192 (calcd. 318.2195, C20H30O3). Aceasta a reprezentat pierderea lanțului lateral heptanoat și adăugarea unui atom de oxigen în substratul 1. Spectrul IR a arătat absorbanțe pentru OH (3.436 cm−1) și carbonili cetonici (1.711 cm−1). În spectrul 1H-RMN, semnalele lanțului de heptanoat și protonul Metin C-17 au fost găsite lipsă, în timp ce un nou semnal de proton Metin de câmp descendent a fost observat la 3.92 (tabelul 1) (fișa tehnică 3). Acest lucru a sugerat hidroxilarea scheletului steroidic și scindarea oxidativă a fragmentului heptanoat. Spectrul 13C-RMN a susținut, de asemenea, inferențele de mai sus. Semnalele de Carbon pentru heptanoat au fost găsite lipsă, în timp ce un nou carbonil cetonic și un oxi-metină au apărut în spectrul 13C-RMN (Tabelul 1). Aceasta a indicat scindarea oxidativă a lanțului heptanoat și hidroxilarea în substratul 1. Protonul metinic nou apărut la 3.92 (h-7) a arătat corelații HMBC cu C-5 și C-8, sugerând un OH la C-7 (Figura 3). Corelațiile HMBC ale lui H3-18 și H2-16 cu un carbon la 223,8 de la XCT au sugerat un carbon cetonic la C-17. OH la C-7 a fost susținut în continuare de corelații confortabile ale H-7 cu H2-6 și H-8. H-7 (3.92, s) a prezentat corelații NOESY cu H-8 orientat axial (1.70, suprapunere), ceea ce a sugerat o orientare a OH la C-7 (Figura 4). Astfel, structura de metabolit 3 a fost dedus ca 2α-metil-7α-hidroxi-5α-androstan-3,17-dionă.
analizele de difracție cu raze X cu un singur cristal au fost, de asemenea, efectuate pe compușii 1 și 5. Compusul 1 era format din patru inele, adică A, B, C și D, cu conformații pentru scaun, scaun, scaun și plic. Un metil a fost prezent la C-2 cu orientare Ecuatorială. Lanțul ester al heptanoatului a fost prezent la C-17 al inelului D (Figura 6). În timp ce, metabolitul 5 conține inele A, B, C și D în conformațiile rindea, scaun, scaun și înveliș. Lanțul lateral al heptanoatului a fost absent în metabolitul 5 (Figura 7). Datele de difracție monocistalină ale metaboliților 1 și 5 au fost transmise colectării datelor cristalografice Cambridge (CCDC 1500705, respectiv CCDC 1500707). Datele de analiză a difracției cu raze X cu un singur cristal ale compușilor 1, 2 și 5 sunt prezentate în tabelul 4.
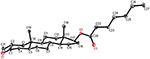
Figura 6. Desen ORTEP generat de Computer al modelului final de raze X al compusului 1. Coduri de culoare: carbon, negru; oxigen, roșu.
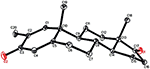
Figura 7. Desen ORTEP generat de Computer al modelului final de raze X al compusului 5. Coduri de culoare: carbon, negru; oxigen, roșu.

Tabelul 4. Analiza difracției cu raze X cu un singur cristal a compușilor 1, 2 și 5.
citotoxicitatea împotriva cancerului HeLa, PC3, H640 și HCT116 și a liniilor celulare normale 3T3
produse naturale, de exemplu flavonoide, steroizi, terpene etc. poate servi ca o sursă excelentă pentru producerea multor medicamente, deoarece acestea sunt raportate pentru multe activități biologice, cum ar fi activități anti-cancer, antiinflamatoare, anti-leishmaniale, anti-bacteriene etc. Prin urmare, este necesar să le derivați, să studiați relația structură-activitate care ar putea fi utilă pentru sinteza medicamentelor sigure și eficiente. În prezent, multe produse farmaceutice sunt sintetizate eficient prin biotransformare microbiană datorită prezenței unei game de enzime în ele. Pe baza activității anticanceroase raportate a drostanolonei (9), a propionatului de drostanolonă și a heptanoatului de drostanolonă (1), compușii 1-9 au fost evaluați pentru citotoxicitate împotriva liniilor celulare canceroase hela, PC-3, H460 și HCT116. Interesant este că toți compușii au prezentat o activitate anti-cancer moderată până la puternică. Activitatea anticanceroasă a compușilor 1-9 a fost dedusă din valorile IC50 împotriva HeLa (carcinom cervical uman), PC-3 (cancer de prostată uman), H460 (cancer pulmonar uman) și HCT116 (cancer de colon uman) (Tabelul 5). Pe baza acestor rezultate, citotoxicitatea acestor compuși a fost, de asemenea, evaluată în raport cu linia celulară normală 3T3 (fibroblast de șoarece), unde toți compușii, cu excepția 8 (IC50 = 74,6 3,7 3,7 mm) și 9 (IC50 = 62,1 1,2 mm), s-au dovedit a fi non-citotoxici.

Tabelul 5. Citotoxicitatea compușilor 1-9 împotriva cancerului HeLa, PC3, H460 și HCT116 și a liniilor celulare normale 3T3.
relația structură-activitate
variațiile structurilor metaboliților le-au afectat activitatea anticanceroasă. Metabolitul 2 cu absența fragmentului de ester și două grupuri aO-H la C-3 și C-14 și un grup de la C-17 cu un grup de la C-17 au prezentat o citotoxicitate mai mică împotriva liniilor celulare canceroase hela, H460 și HCT116, dar activitatea sa anticanceroasă a fost mai mare împotriva liniei celulare canceroase PC-3, comparativ cu compusul 1. Metabolitul 3 cu pierderea grupului ester și a două grupuri ceto la C-3 și C-17 și grupul aO-H la C-7 a arătat, de asemenea, o activitate mai mică împotriva liniilor celulare canceroase hela, H460 și HCT116, dar activitate crescută împotriva liniei celulare canceroase PC-3 în comparație cu substratul 1. Reducerea carbonilului C-3 La O-H și scindarea hidrolitică a fragmentului de ester din compusul 4 și-au crescut activitatea atât împotriva liniilor celulare canceroase HeLa, cât și PC-3 într-o oarecare măsură, dar activitatea sa anti-cancer împotriva liniilor celulare canceroase H460 și HCT116 a scăzut în comparație cu substratul 1. Prezența C = C între C-1/C-2 și C-4 / C-5, împreună cu C = o la C-3 și C-17 au făcut din metabolitul 5 un agent puternic anti-cancer împotriva liniei celulare canceroase HeLa, comparativ cu substratul 1 și medicamentul standard (cisplatină). Mai mult, activitatea sa anti-cancer împotriva liniei celulare canceroase PC-3 a fost, de asemenea, crescută în comparație cu substratul 1. Interesant este că activitatea sa anti-cancer împotriva liniilor celulare h460 și HCT116 a fost mai mică în comparație cu compusul 1. Prezența C = C între C-1/C-2 și C-4 / C-5, C = o la C-3 și C-17, împreună cu grupul aO-H la C-11 în metabolitul 6 și-a crescut activitatea anti-cancer împotriva liniilor celulare canceroase HeLa și PC-3 în comparație cu substratul 1 și a arătat un potențial anti-cancer similar împotriva liniei celulare canceroase HeLa ca medicament standard (cisplatină). Cu toate acestea, activitatea sa anti-cancer împotriva liniilor celulare h460 și HCT116 a scăzut în comparație cu compusul 1. Prezența C = C între C-1/C-2 și C-4 / C-5, C = o la C-3 și C-17, împreună cu grupul aO-H la C-14 în metabolitul 7 a crescut din nou activitatea anti-cancer împotriva liniilor celulare hela și PC-3 și a scăzut activitatea anti-cancer împotriva liniilor celulare H460 și HCT116 în comparație cu substratul 1. Prezența C = C la C-1/C-2, C = O la C-3 și C-17 și aOH la C-7 a făcut ca metabolitul 8 să fie cel mai puternic anti-cancer împotriva liniei celulare canceroase HeLa în comparație cu substratul 1 și medicamentul standard (cisplatină). De asemenea, a arătat o activitate bună împotriva liniei celulare canceroase PC-3, dar a scăzut activitatea anti-cancer împotriva liniilor celulare canceroase H460 și HCT116 în comparație cu substratul 1. Metabolitul 9 cu doar hidroliză la C-17 a arătat o activitate anticanceroasă crescută împotriva liniilor celulare canceroase hela, PC-3 și HCT116, dar a scăzut citotoxicitatea împotriva liniei celulare canceroase H460 în comparație cu substratul 1 și medicamentul standard (cisplatină). Pe baza discuției de mai sus, se poate concluziona că creșterea activității anticanceroase a compușilor 5-8 împotriva hela și a liniilor celulare canceroase PC-3 s-a datorat probabil prezenței C = C la C-1/C-2 și carbonil cetonă la C-3 și C-17 în comparație cu substratul 1.
concluzie
contribuții autor
conceptul cercetării prezentate a fost elaborat și proiectat de MIC. MIC a fost, de asemenea, supraveghetorul proiectului. Toate datele au fost analizate și interpretate de MIC, A-t-W și HC. MS, SY, MA și NF au efectuat experimentele. MIC, A-T-W și MS au scris manuscrisul. Toți autorii au revizuit manuscrisul. Versiunea finală a manuscrisului a fost, de asemenea, aprobată de MIC înainte de depunere.
Declarație privind conflictul de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
A-t-W, și MIC recunosc rolul de facilitare a Comisiei de învățământ superior, Islamabad, Pakistan, printr-un sprijin financiar în cadrul „Studii privind Chemoprevenția carcinogenezei mamare de către agenții dietetici, (20-3790/nrpu/R&D/HEC/13 / 793).”SY recunoaște sprijinul financiar al OIAC (Organizația pentru Interzicerea Armelor Chimice) printr-un proiect de cercetare intitulat „studii structurale și biologice asupra noilor steroizi anabolizanți obținuți prin biotransformare.”HC recunoaște sprijinul financiar al” Decanatului cercetării științifice (DSR), Universitatea King Abdulaziz, Ministerul Educației, Arabia Saudită.”
material suplimentar
Eastman, A. (1999). „Mecanismul de acțiune al cisplatinei: de la aducți la apoptoză”, în cisplatină: Chimia și biochimia unui medicament anticanceros principal, ed B. Lippert (Z Oustrich: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002 / 9783906390420.ch4
CrossRef Full Text | Google Scholar
Vardar, E., Vardar, S. A. și Cengiz, T. (2002). Abuzul de steroizi anabolici-androgenici. Anato. J. Psihiatrie 3, 104-107.