Existen métodos experimentales para la detección de electrones no apareados. Una de las características distintivas de los electrones no emparejados en los materiales es la interacción con un campo magnético. Esa interacción puede utilizarse para proporcionar información sobre compuestos que contienen electrones no emparejados.
Resonancia paramagnética electrónica
La resonancia paramagnética electrónica (EPR) o resonancia de espín electrónico (ESR) es un método espectroscópico. Depende de la separación energética de dos estados de espín que existe solo en presencia de un campo magnético.
La RPE está estrechamente relacionada con otro tipo común de espectroscopia de resonancia por espín, la RMN.
El espín es una propiedad cuántica que no tiene ninguna analogía real que tenga sentido para nosotros a nivel macroscópico. Sin embargo, sabemos que el espín tiene propiedades magnéticas asociadas. Un electrón puede tener cualquiera de los dos valores para estas propiedades magnéticas. Hay varias etiquetas para estos valores: a veces «arriba» y «abajo», a veces, +1/2 y -1/2. Sin embargo, cualquier valor de espín que posea un electrón no hace ninguna diferencia energéticamente.
Los dos estados de espín posibles son los mismos energéticamente unless a menos que haya un campo magnético presente. Una vez que surge esa situación, hay una separación energética entre los dos estados.
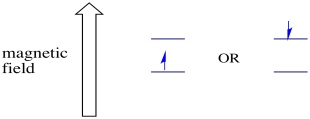
En presencia de un campo magnético, los dos estados de espín se separan en dos niveles de energía diferentes. La cantidad de separación entre los niveles de energía depende de la magnitud del campo magnético. Cuanto más fuerte sea el campo magnético, mayor será la separación.
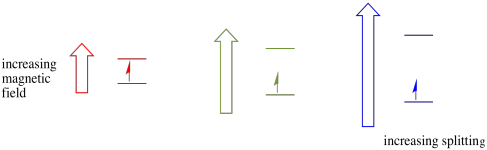
Este caso sólo es cierto para los espines no apareados. Recuerde, los giros no emparejados interactúan con un campo magnético. Si todo está emparejado, no pasa nada. Eso es muy útil, porque nos da una forma de detectar esos electrones no emparejados.
Un electrón en un estado de espín todavía puede ser excitado al otro por la absorbancia de un fotón. Alternativamente, un electrón en el estado superior puede descender al inferior si libera un fotón.
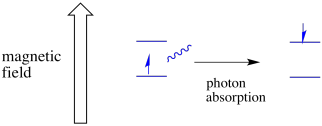
Para que esto ocurra, la energía del fotón debe coincidir exactamente con la diferencia de energía entre estados. Esta regla de ricitos de oro se llama condición de resonancia. La cantidad de energía suministrada para saltar de un nivel de energía al siguiente tiene que ser la correcta. Muy poca energía y el electrón no lo logrará. Demasiada energía y el electrón tampoco lo logrará. Está esperando el fotón correcto.
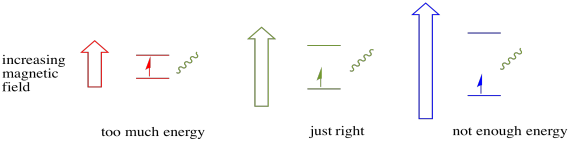
¿Cuánta energía tiene un fotón? Recuerda tu relación Planck-Einstein. Describe la energía de un fotón:
\(E = h \ nu\)
E es la energía del fotón, h es la constante de Planck (6.625 x 10-34 Js) y ν es la frecuencia del fotón (se parece a una v romana, pero es la letra griega, nu).
Alternativamente, debido a la relación entre la longitud de onda y la frecuencia:
\(E = \ frac{hc} {\lambda}\)
Las nuevas cantidades son c, la velocidad de la luz (3,0 x 108 m s-1) y λ, la longitud de onda del fotón.
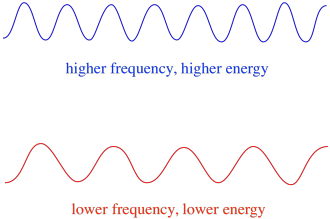
Por lo tanto, en general, diferentes longitudes de onda de luz entregan diferentes cantidades de energía. La luz azul, con una longitud de onda cercana a 475 nm, tiene más energía que la luz roja, con una longitud de onda cercana a 700 nm.
En EPR, el rango general de radiación electromagnética, o el tipo general de fotón, es la radiación de microondas. La frecuencia de estos fotones es de aproximadamente 9 o 10 GHz. (Otro tipo de espectroscopia, la espectroscopia rotacional, también mide la absorbancia de microondas. Por lo general, utiliza frecuencias de microondas algo más altas. La espectroscopia rotacional proporciona información estructural o de unión sobre moléculas en la fase gaseosa.)
Dependiendo del entorno del electrón no emparejado, puede ser más o menos susceptible a la influencia del campo magnético externo. Eso significa que la energía que se divide entre los dos estados de espín variará de una molécula a otra. Como resultado, diferentes moléculas en el mismo campo magnético absorberían diferentes longitudes de onda de radiación de microondas.
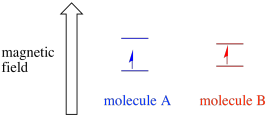
Por lo general, un espectrómetro EPR está diseñado para suministrar una longitud de onda fija de radiación de microondas a la muestra. El campo magnético se ajusta y el instrumento mide la intensidad de campo requerida para la absorción de los fotones. Un espectro EPR muestra la absorbancia en función de la intensidad del campo magnético.
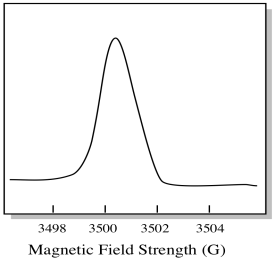
Hay algo un poco diferente en cómo se muestran generalmente los espectros EPR. Se muestra como un derivado de la gráfica mostrada anteriormente. Esto se debe a la forma en que el instrumento mide el cambio en la absorbancia a medida que cambia el campo magnético; es decir, mide d(absorbancia)/d(campo magnético). Esa es la pendiente de la parcela anterior.
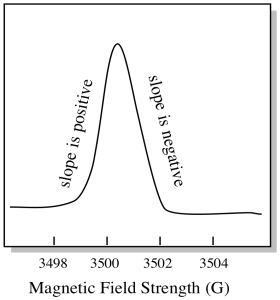
Como resultado, un espectro EPR realmente se parece más a esto. La parte por encima de la línea de base refleja la pendiente positiva en la parcela anterior. La parte inferior de la línea de base refleja la pendiente negativa de la parcela anterior.
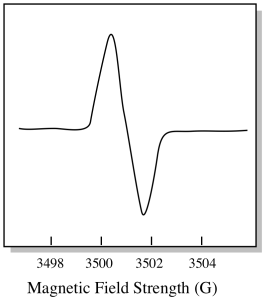
La intensidad del campo magnético no suele ser el valor que se informa para la posición de pico. En su lugar, se informa de algo llamado valor g. El valor g surge de la ecuación para el efecto Zeeman (el efecto del campo magnético en la división entre los niveles de energía de espín). Esa relación es:
\(\Delta E = g \beta B\)
en la que ΔE es la diferencia de energía entre los estados de espín, g es el valor g, una constante de proporcionalidad que depende de cuán susceptible es el electrón a la influencia del campo magnético, β es el magnetón de Bohr (9.274 x 10-24 J T-1) y B es el campo magnético aplicado.
lo que significa Que, para la absorción de fotones,
\(h \nu = g \beta B\)
y
\(g = \frac{ h \nu}{\beta B}\)
Recuerde, h y β son sólo constantes. Eso significa que g es una medida de la relación entre el fotón absorbido y el campo magnético utilizado. Es un paso de estandarización. Si las personas tienen instrumentos que usan longitudes de onda ligeramente diferentes de radiación de microondas, entonces los campos magnéticos que miden para las mismas muestras no estarían de acuerdo. Si todo el mundo solo mide la relación de longitud de onda a la intensidad del campo, todo debería equilibrarse. El valor g es una medida reproducible del entorno de un electrón que debe ser el mismo de un laboratorio a otro.
Una práctica similar se utiliza en la espectroscopia de RMN, por razones similares. Cuando reportamos un cambio químico en ppm en lugar de Hz, estamos corrigiendo la fuerza del campo magnético en el instrumento que estamos utilizando. De lo contrario, la misma muestra daría dos turnos diferentes en dos instrumentos diferentes.
Acoplamiento en EPR
El acoplamiento es un fenómeno en el que los campos magnéticos interactúan entre sí. En EPR, el acoplamiento se produce debido a la influencia de núcleos cercanos en el electrón que se está observando.
Por ejemplo, es posible que ya sepas que el núcleo de un átomo de hidrógeno tiene un giro no emparejado. Esa es la base de la espectroscopia de RMN de 1H. Si ese núcleo tiene un espín no emparejado, tiene un campo magnético asociado. Debido a que el núcleo de hidrógeno podría tener un valor de espín, +1/2 o -1/2, entonces tiene dos posibles campos magnéticos asociados con él.
Un electrón cercano, colocado en un campo magnético externo, ahora podría estar en cualquiera de dos situaciones diferentes. O el protón vecino añade un poco al campo magnético, o resta un poco del campo externo.
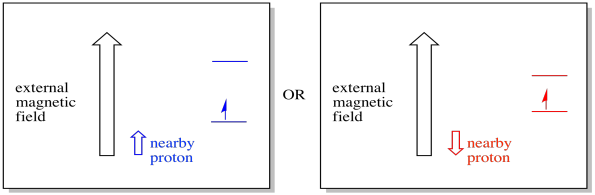
Como resultado, el electrón puede experimentar dos campos diferentes. Recuerde, no estamos tratando con una sola molécula en espectroscopia. Estamos tratando con un gran número de moléculas. Algunas de las moléculas estarán en una sola situación. Algunas de las moléculas estarán en la otra situación. Veremos ambas situaciones. Habrá absorbancia en dos campos magnéticos diferentes.

Como resultado, el espectro EPR muestra dos picos, como este:
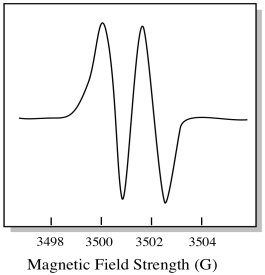
Este tipo de pico en el espectro se llama doblete, debido a la doble absorbancia. Esta característica de un pico de EPR se llama su multiplicidad. ¿En cuántas líneas se divide el pico? Dos. Es un doblete.
Las cosas son aún más interesantes si hay dos protones cercanos. En ese caso, ambos protones vecinos tienen espín. Cualquiera de los giros puede tener valor +1/2 o -1/2. Tal vez ambos son +1/2. Tal vez ambos son -1/2. Tal vez haya uno de cada uno. Estas tres combinaciones posibles tendrán tres efectos diferentes en el campo magnético experimentado por el electrón.
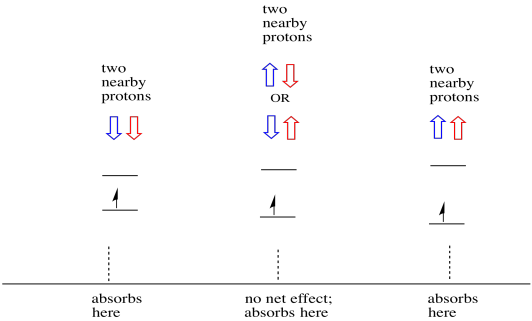
Como resultado, hay tres picos en el espectro. El espectro se llama triplete. Este triplete se muestra a continuación, debajo del diagrama que ilustra las combinaciones de espín de los hidrógenos vecinos.
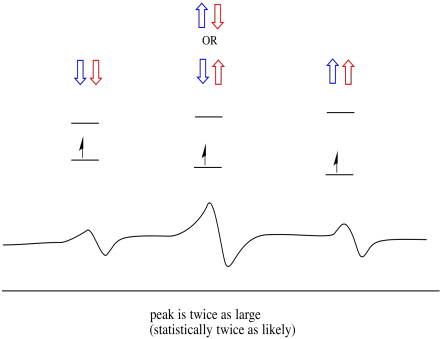
Observe que, debido a que el hidrógeno puede estar arriba o abajo en la combinación mixta, hay dos formas de llegar a ese estado intermedio. Esa combinación es el doble de probable que las otras dos, porque solo hay una forma de obtener esa combinación: los giros de ambos hidrógenos aumentan, en un caso. Ambos hidrógenos están en el otro. Como resultado, el pico medio en un triplete es el doble de grande que los picos en los bordes.
El ejercicio \(\pageIndex{1}\)
Muestra que, con tres hidrógenos vecinos, resultaría un cuarteto, en el que las proporciones de los picos son 1:3:3:1.
Respuesta
Las combinaciones son:
a) todas las tiradas abajo (y sólo hay una manera de hacerlo)
b) dos de los espines están abajo, pero uno es (y cada uno de los tres protones podrían estar arriba, así que hay tres formas de hacerlo)
c) dos de los giros son, pero es hacia abajo (y cada uno de los tres protones podría ser, así que hay tres formas de hacerlo)
d) todas las tiradas (y solo hay una manera de hacer eso).
El resultado es un cuarteto 1:3:3:1.
Ejercicio \(\pageIndex{2}\)
Predecir la multiplicidad en el espectro EPR para cada uno de los siguientes radicales alcoxi (tenga en cuenta que el oxígeno y el carbono no tienen espines no emparejados; suponga que lo mismo es cierto para X):
a) X3C-O. b) X2CH-O. c) XCH2-O. d) CH3-O.
Respuesta a)
a) singlet
Respuesta b)
b) doblete
Respuesta c)
c) triplete
Respuesta d)
d) cuarteto
Ejercicio \(\pageIndex{3}\)
Supongamos que el benceno se redujo en un electrón para obtener el anión radical de benceno. ¿Cuál sería la multiplicidad en el espectro EPR?
Respuesta
Un septeto (en a 1:3:5:7:5:3:1 ratio).
Acoplamiento a iones metálicos
Muchos núcleos distintos del hidrógeno tienen un espín neto. Si el electrón no emparejado se encuentra en un metal, el espectro EPR puede proporcionar confirmación de esa información estructural. Esta confirmación puede provenir tanto de la información del campo magnético (similar al desplazamiento químico en la RMN) como de la multiplicidad.
Los espines nucleares de metales seleccionados se muestran a continuación.
| Metal | Spin |
| V | 7/2 |
| Mn | 5/2 |
| Fe | 0 |
| Co | 7/2 |
| Cu | 3/2 |
En cada uno de estos metales, el núcleo tiene diferentes campos magnéticos. Tenga en cuenta que sus efectos son un poco más complicados que los de un átomo de hidrógeno. Por ejemplo, el cobre, con espín 3/2, actúa un poco como tres núcleos de hidrógeno diferentes (cada uno con espín + / – 1/2) en términos de su efecto en el espectro EPR de un electro cercano. La multiplicidad de un electrón no emparejado en un ion de cobre debería ser bastante distintiva.
Ejercicio\(\pageIndex{4}\)
Predecir la multiplicidad de un pico en el espectro EPR para un electrón no emparejado en cada uno de los siguientes metales:
a) vanadio b) manganeso c) hierro d) cobalto e) cobre
Respuesta a)
a) un octeto (en 1:3:5:7:7:5:3:1 ratio)
Respuesta b)
b) un sexteto (en a 1:3: 5: 5: 3:relación 1)
Respuesta c)
c) un singlete
Respuesta d)
d) un octeto
Respuesta e)
e) un cuarteto (en una relación de 1:3:3:1)
A veces las cosas son más complicadas, porque diferentes isótopos del mismo elemento pueden tener diferentes valores de espín posibles. De hecho, eso es cierto con el hidrógeno y el carbono, pero la gran mayoría del hidrógeno se encuentra como 1H, por lo que en general podemos pensar que tiene espín = 1/2; la gran mayoría del carbono es 12C, con espín = 0.
Los isótopos naturales de hierro, y sus espines nucleares, se muestran en la siguiente tabla.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. Dentro de la muestra, algunos de los electrones estarían situados en iones de hierro con espín = 1/2, aunque la mayoría no. Esta complicación puede ser suficiente para introducir una ligera variación en la apariencia del espectro, pero en general todavía parecen mucho a un singlete.
Sin embargo, en muchos casos las cosas se vuelven mucho más complejas. El molibdeno es un buen ejemplo.
| Isótopos | Spin | % La abundancia |
| 92Mo | 0 | 14.8 |
| 94Mo | 0 | 9.3 |
| 95Mo | 5/2 | 15.9 |
| 96Mo | 0 | 16.7 |
| 97Mo | 5/2 | 9.6 |
| 98Mo | 0 | 24.1 |
| 100Mo | 0 |
Hay siete isótopos naturales de molibdeno. Cinco de ellos tienen espín = 0, por lo que un electrón no emparejado en esos isótopos daría lugar a un simple singlete en el espectro EPR. Los otros dos isótopos, que comprenden el 25% del total, tienen espín = 5/2. La mayoría de los electrones no apareados en molibdeno se mostrarían como un singlete. Sin embargo, una fracción significativa aparecería como un sexteto. Eso significa que, en un caso ideal, un electrón no emparejado en molibdeno daría lugar a un singlete con un sexteto superpuesto sobre él (aproximadamente una cuarta parte tan fuerte como el singlete).
Esta situación podría parecerse al dibujo de abajo.
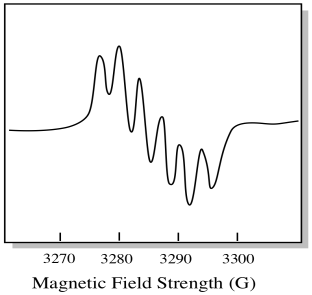
En realidad, los espectros EPR son enormemente complicados en muchos casos. A menudo parecen manchas borrosas. Hay tantas cosas que se acoplan a tantas otras que se vuelve casi imposible descifrarlas a simple vista. En la mayoría de los casos, se ejecutan simulaciones por computadora y los datos experimentales se comparan con las simulaciones por computadora para obtener información estructural.
Ejercicio \(\pageIndex{5}\)
El vanadio está presente en algunas nitrogenasas, por lo que ha habido interés en complejos modelo (por ejemplo, Sandro Gambarotta et al, J. Am. Chem. Soc. 1994, 116, 6927-6928). Gambarotta utilizó la siguiente síntesis, en disolvente THF:
\(\ce{VCl3 + K -> 3V (THF)}\)
- Dibuje la estructura del producto de la reacción.
- Dibuja un diagrama de división orbital d para este complejo.
- Se registró un espectro EPR para este compuesto. Dibuje el espectro, dado que el vanadio tiene un espín nuclear I = 7/2.
- Estimar µeff para este compuesto.
El compuesto reacciona con N2, formando un dímero con puente N2.
e) Dibuja la estructura de este producto.
f) Este compuesto no produce espectro EPR. Proporcione una estructura de resonancia de (e) que explique esta observación.
Answer
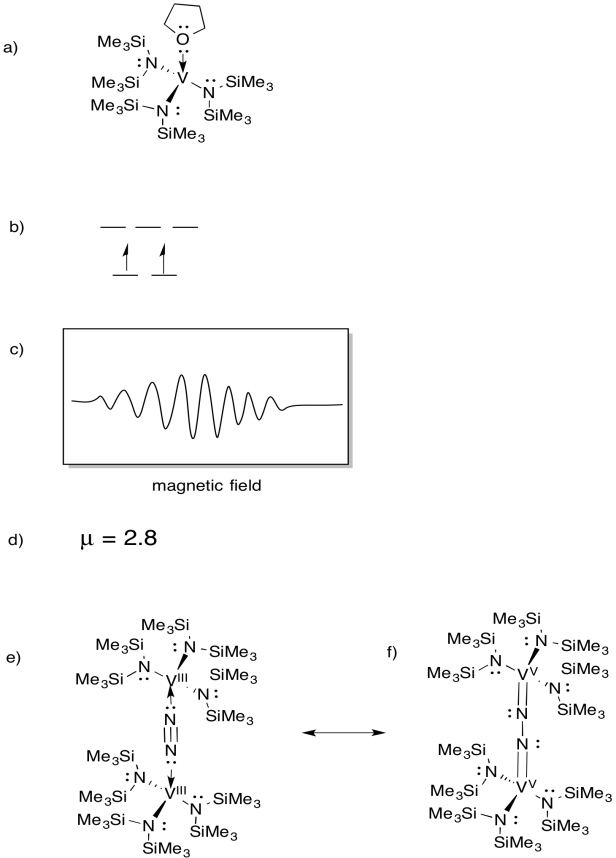
espectros EPR proporcionados por cortesía de Virtual Imagination / Slapdash Chemistry Creations.
Atribución
Chris P Schaller, Ph D., (Universidad de San Benito / Saint John’s University)