există metode experimentale pentru detectarea electronilor nepereche. Unul dintre semnele distinctive ale electronilor nepereche din materiale este interacțiunea cu un câmp magnetic. Această interacțiune poate fi utilizată pentru a furniza informații despre compușii care conțin electroni nepereche.
rezonanța paramagnetică Electronică
rezonanța paramagnetică Electronică (EPR) sau rezonanța de spin electronică (ESR) este o metodă spectroscopică. Depinde de separarea energetică a două stări de spin care există numai în prezența unui câmp magnetic.
EPR este foarte strâns legată de un alt tip comun de spectroscopie de rezonanță spin, RMN.
spinul este o proprietate cuantică care nu are nicio analogie reală care ar avea sens pentru noi la nivel macroscopic. Cu toate acestea, știm că spinul a asociat cu acesta proprietăți magnetice. Un electron poate avea oricare dintre cele două valori pentru aceste proprietăți magnetice. Există diferite etichete date acestor valori: uneori „sus” și „jos”, alteori, +1/2 și -1/2. Cu toate acestea, orice valoare a spinului pe care o posedă un electron nu face nicio diferență din punct de vedere energetic.
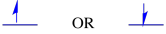
cele două stări de spin posibile sunt aceleași din punct de vedere energetic-cu excepția cazului în care este prezent un câmp magnetic. Odată ce apare această situație, există o separare energetică între cele două stări.
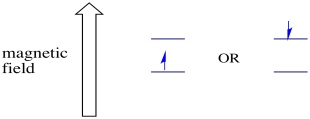
în prezența unui câmp magnetic, cele două stări de spin se separă în două niveluri de energie diferite. Cantitatea de separare între nivelurile de energie depinde de magnitudinea câmpului magnetic. Cu cât câmpul magnetic este mai puternic, cu atât este mai mare separarea.
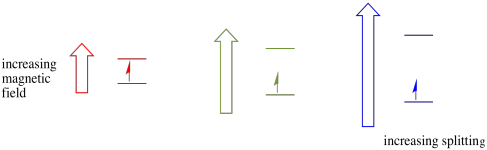
acest caz este valabil numai pentru rotiri nepereche. Amintiți-vă, rotirile nepereche interacționează cu un câmp magnetic. Dacă totul este spin-pereche, nu se întâmplă nimic. Acest lucru este foarte util, deoarece ne oferă o modalitate de a detecta acei electroni nepereche.
un electron într-o stare de spin poate fi încă excitat la celălalt prin absorbanța unui foton. Alternativ, un electron în starea superioară poate scădea la cel inferior dacă eliberează un foton.
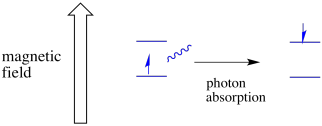
pentru ca toate acestea să se întâmple, energia fotonului trebuie să se potrivească exact cu diferența de energie dintre stări. Această regulă Goldilocks se numește starea de rezonanță. Cantitatea de energie furnizată pentru a sări de la un nivel de energie la altul trebuie să fie corectă. Prea puțină energie și electronul nu va reuși. Prea multă energie și nici electronul nu va reuși. Așteaptă doar fotonul potrivit.
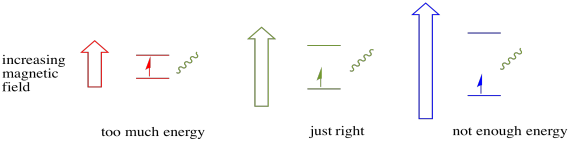
câtă energie are un foton? Amintiți-vă relația Planck-Einstein. Acesta a descris energia unui foton:
\(E=h \nu\)
E este energia fotonului, H este constanta lui Planck (6.625 x 10-34 Js), iar XV este frecvența fotonului (arată ca un vee Roman, dar este litera greacă, nu).
alternativ, din cauza relației dintre lungimea de undă și frecvența:
\(e= \frac{HC}{\lambda}\)
noile cantități sunt C, viteza luminii (3,0 x 108 m s-1) și INQUA, lungimea de undă a fotonului.
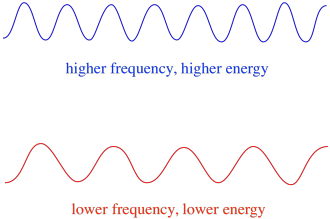
Deci, în general, diferite lungimi de undă ale luminii furnizează cantități diferite de energie. Lumina albastră, cu o lungime de undă apropiată de 475 nm, are mai multă energie decât lumina roșie, cu o lungime de undă apropiată de 700 nm.
în EPR, gama generală de radiații electromagnetice, sau tipul general de foton, este radiația cu microunde. Frecvența acestor fotoni este de aproximativ 9 sau 10 GHz. (Un alt tip de spectroscopie, spectroscopia rotativă, măsoară, de asemenea, absorbanța microundelor. De obicei folosește frecvențe ceva mai mari ale microundelor. Spectroscopia rotativă oferă informații structurale sau de legătură despre moleculele din faza gazoasă.)
în funcție de mediul electronului nepereche, acesta poate fi mai susceptibil sau mai puțin susceptibil la influența câmpului magnetic extern. Aceasta înseamnă că împărțirea energiei între cele două stări de spin va varia de la o moleculă la alta. Ca rezultat, diferite molecule din același câmp magnetic ar absorbi diferite lungimi de undă ale radiației cu microunde.
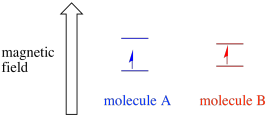
de obicei, un spectrometru EPR este proiectat astfel încât să furnizeze eșantionului o lungime de undă fixă de radiații cu microunde. Câmpul magnetic este reglat și instrumentul măsoară ce intensitate a câmpului a fost necesară pentru absorbția fotonilor. Un spectru EPR arată absorbanța în funcție de Intensitatea câmpului magnetic.
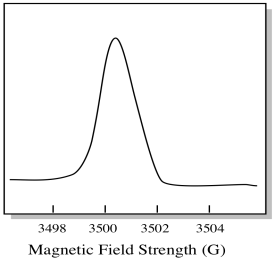
există ceva puțin diferit în ceea ce privește modul în care sunt afișate de obicei spectrele EPR. Este afișat ca un derivat al complotului prezentat mai sus. Acest lucru se datorează modului în care instrumentul măsoară schimbarea absorbanței pe măsură ce schimbă câmpul magnetic; adică măsoară d(absorbanță)/d(câmp magnetic). Aceasta este panta parcelei anterioare.
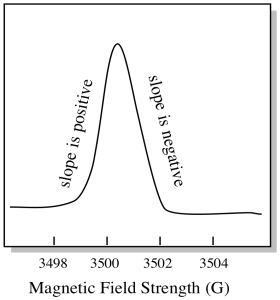
ca urmare, un spectru EPR arată într-adevăr mai mult așa. Partea de deasupra liniei de bază reflectă panta pozitivă din graficul anterior. Partea de sub linia de bază reflectă panta negativă din graficul anterior.
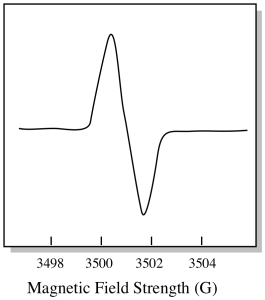
Intensitatea câmpului magnetic nu este de obicei valoarea raportată pentru poziția de vârf. În schimb, este raportat ceva numit valoarea G. Valoarea g provine din ecuația pentru efectul Zeeman (efectul câmpului magnetic asupra împărțirii dintre nivelurile de energie de spin). Această relație este:
\(\Delta E = G\beta B\)
în care XQUSTE este diferența de energie dintre stările de spin, g este valoarea g, o constantă de proporționalitate care depinde de cât de susceptibil este electronul la influența câmpului magnetic, xqua este magnetonul Bohr (9,274 x 10-24 J T-1) și B este câmpul magnetic aplicat.
asta înseamnă că, pentru absorbția fotonilor,
\(h \nu = G \beta b\)
și așa
\(g = \frac{ h \nu}{\beta b}\)
amintiți-vă, h și XV sunt doar constante. Asta înseamnă că g este o măsură a raportului dintre fotonul absorbit și câmpul magnetic Utilizat. Este un pas de standardizare. Dacă oamenii au instrumente care utilizează lungimi de undă ușor diferite de radiații cu microunde, atunci câmpurile magnetice pe care le măsoară pentru aceleași probe nu ar fi de acord. Dacă toată lumea măsoară doar raportul dintre lungimea de undă și intensitatea câmpului, ar trebui să se uniformizeze. Valoarea g este o măsură reproductibilă a mediului unui electron care ar trebui să fie aceeași de la un laborator la altul.o practică similară este utilizată în spectroscopia RMN, din motive similare. Când raportăm o schimbare chimică în ppm în loc de Hz, corectăm Intensitatea câmpului magnetic din instrumentul pe care îl folosim. În caz contrar, același eșantion ar da două schimburi diferite pe două instrumente diferite.
cuplarea în EPR
cuplarea este un fenomen în care câmpurile magnetice interacționează între ele. În EPR, cuplarea are loc din cauza influenței nucleelor din apropiere asupra electronului care este observat.
de exemplu, este posibil să știți deja că nucleul unui atom de hidrogen are un spin nepereche. Aceasta este baza spectroscopiei 1H RMN. Dacă acel nucleu are un spin nepereche, are un câmp magnetic asociat. Deoarece nucleul de hidrogen ar putea avea fie o valoare de spin, +1/2 sau -1/2, atunci are două câmpuri magnetice posibile asociate cu acesta.
un electron din apropiere, plasat într-un câmp magnetic extern, ar putea fi acum în oricare dintre cele două situații diferite. Fie protonul vecin adaugă puțin câmpului magnetic, fie scade puțin din câmpul extern.
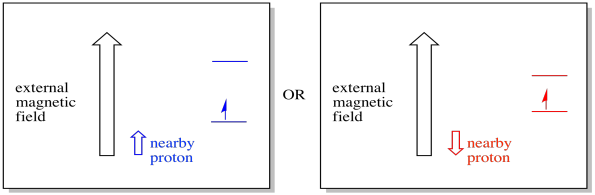
ca urmare, electronul poate experimenta două câmpuri diferite. Amintiți-vă, nu avem de-a face cu o singură moleculă în spectroscopie. Avem de-a face cu un număr imens de molecule. Unele dintre molecule vor fi într-o singură situație. Unele dintre molecule vor fi în cealaltă situație. Vom vedea ambele situații. Va exista absorbanta la doua forte diferite ale campului magnetic.

ca urmare, spectrul EPR prezintă două vârfuri, astfel:
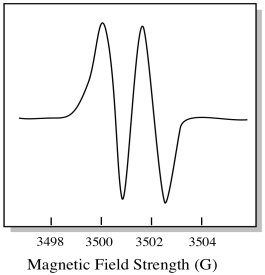
acest tip de vârf din spectru se numește dublet, din cauza absorbanței duble. Această caracteristică a unui vârf EPR se numește multiplicitatea sa. În câte linii este împărțit vârful? Doi. Este un dublet.
lucrurile sunt și mai interesante dacă există doi protoni în apropiere. În acest caz, ambii protoni vecini au spin. Fie rotire ar putea avea o valoare +1/2 sau -1/2. Poate că ambele sunt +1/2. Poate că ambele sunt -1 / 2. Poate că există unul din fiecare. Aceste trei combinații posibile vor avea trei efecte diferite asupra câmpului magnetic experimentat de electron.
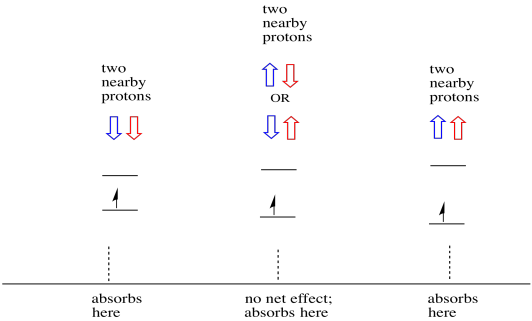
ca urmare, există trei vârfuri în spectru. Spectrul se numește triplet. Acest triplet este prezentat mai jos, sub diagrama care ilustrează combinațiile de spin ale hidrogenilor vecini.
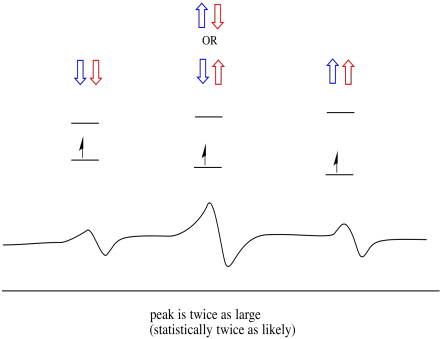
observați că, deoarece hidrogenul ar putea fi în sus sau în jos în combinația mixtă, există două moduri de a ajunge la acea stare de mijloc. Această combinație este de două ori mai probabilă decât celelalte două, deoarece există o singură modalitate de a obține acea combinație: ambele rotiri ale hidrogenilor sunt în sus, într-un caz. Ambii hidrogeni sunt în celălalt. Ca urmare, vârful de mijloc într-un triplet este de două ori mai mare decât vârfurile de pe margini.
exercițiu \(\PageIndex{1}\)
arată că, cu trei hidrogeni vecini, ar rezulta un cvartet, în care raporturile vârfurilor sunt 1:3:3:1.
răspuns
combinațiile sunt:
a) toate rotirile în jos (și există o singură modalitate de a face asta)
b) două dintre rotiri sunt în jos, dar unul este în sus (și fiecare dintre cei trei protoni ar putea fi în sus, deci există trei moduri de a face asta)
c) două dintre rotiri sunt în sus, dar unul este în jos (și fiecare dintre cei trei protoni ar putea fi în jos, deci există trei moduri de a face asta)
d) Toate asta).
rezultatul este un cvartet 1:3:3:1.
Exercise \(\PageIndex{2}\)
prezice multiplicitatea în spectrul EPR pentru fiecare dintre următorii radicali alcoxi (rețineți că oxigenul și carbonul nu au rotiri nepereche; presupun că același lucru este valabil și pentru X):
a) X3C-O. b) X2CH-O. c) XCH2-O. d) CH3-O.
răspuns a)
a) singlet
răspuns b)
b) dublet
răspuns c)
c) triplet
răspuns D)
D) cvartet
exercițiu \(\pageindex{3}\)
să presupunem că benzenul a fost redus cu un electron pentru a obține anionul radical benzenic. Care ar fi multiplicitatea în spectrul EPR?
răspuns
un septet (într-un 1:3:5:7:5:3:1 raport).
cuplarea la ionii metalici
O mulțime de nuclee, altele decât hidrogenul, au o rotire netă. Dacă electronul nepereche se întâmplă să fie găsit pe un metal, spectrul EPR poate furniza confirmarea acestor informații structurale. Această confirmare poate proveni atât din informațiile câmpului magnetic (similar cu schimbarea chimică în RMN), cât și din multiplicitate.
rotirile nucleare ale metalelor selectate sunt prezentate mai jos.
| Metal | Spin |
| V | 7/2 |
| Mn | 5/2 | Fe | 0 | co | 7/2 | cu | 3/2 |
în fiecare dintre aceste metale, nucleul are diferite câmpuri magnetice posibile. Rețineți că efectele lor sunt puțin mai complicate decât cele ale unui atom de hidrogen. De exemplu, cuprul, cu spin 3/2, acționează puțin ca trei nuclee de hidrogen diferite (fiecare cu spin +/- 1/2) în ceea ce privește efectul său asupra spectrului EPR al unui electrom din apropiere. Multiplicitatea unui electron nepereche pe un ion de cupru ar trebui să fie destul de distinctivă.
Exercise \(\PageIndex{4}\)
prezice multiplicitatea unui vârf în spectrul EPR pentru un electron nepereche pe fiecare dintre următoarele metale:
a) vanadiu b) mangan c) fier d) cobalt e) cupru
Răspuns a)
a) un octet (într-un 1:3:5:7:7:5:3:1 răspuns b)
b) un sextet (într-un 1:3:5:5:3:1)
răspuns c)
c) un singlet
răspuns d)
d) un octet
răspuns e)
e) un cvartet (într-un raport 1:3:3:1)
uneori lucrurile sunt mai complicate, deoarece izotopi diferiți ai aceluiași element pot avea valori diferite de spin posibile. De fapt, acest lucru este adevărat cu hidrogenul și carbonul, dar marea majoritate a hidrogenului se găsește ca 1H, deci, în general, ne putem gândi la el ca având spin = 1/2; marea majoritate a carbonului este 12C, cu spin = 0.
izotopii naturali ai fierului și rotirile lor nucleare sunt prezentate în tabelul de mai jos.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. În cadrul eșantionului, unii dintre electroni ar fi situați pe ioni de fier cu spin = 1/2, deși majoritatea nu ar fi. Această complicație poate fi suficientă pentru a introduce o ușoară variație a aspectului spectrului, dar, în general, ar arăta în continuare destul de mult ca un singlet.
cu toate acestea, în multe cazuri lucrurile devin mult mai complexe. Molibdenul oferă un bun exemplu.
| izotop | Spin | % abundență |
| 92Mo | 0 | 14,8 |
| 94mo | 0 | 9.3 |
| 95Mo | 5/2 | 15,9 | 96Mo | 0 | 16,7 | 97Mo | 5/2 | 9.6 | 98mo | 0 | 24.1 | 100mo | 0 |
există șapte izotopi naturali ai molibdenului. Cinci dintre ele au spin = 0, deci un electron nepereche pe acei izotopi ar da naștere unui simplu singlet în spectrul EPR. Ceilalți doi izotopi, cuprinzând 25% din total, au spin = 5/2. Majoritatea electronilor nepereche de pe molibden ar apărea ca un singlet. Cu toate acestea, o fracțiune semnificativă ar apărea ca un sextet. Asta înseamnă că, într-un caz ideal, un electron nepereche pe molibden ar da naștere unui singlet cu un sextet suprapus pe el (aproximativ un sfert la fel de puternic ca singletul).
această situație ar putea arăta cam ca desenul de mai jos.
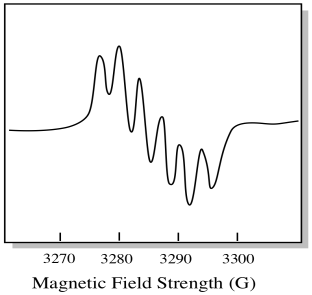
în realitate, spectrele EPR sunt extrem de complicate în multe cazuri. Adesea arată ca niște pete fuzzy. Există atât de multe lucruri care se cuplează cu atât de multe alte lucruri încât devine aproape imposibil de descifrat prin ochi. În cele mai multe cazuri, simulările pe computer sunt rulate și datele experimentale sunt comparate cu simulările pe computer pentru a obține o perspectivă structurală.
Exercise \(\PageIndex{5}\)
vanadiul este prezent în unele azotaze și astfel a existat interes pentru complexele model (de exemplu, Sandro Gambarotta și colab., J. am. Chem. Soc. 1994, 116, 6927-6928). Gambarotta a utilizat următoarea sinteză, în solvent THF:
\(\ce{VCl3 + K -> 3V (THF)}\)
- desenați structura produsului reacției.
- desenați o diagramă de divizare orbitală D pentru acest complex.
- a fost înregistrat un spectru EPR pentru acest compus. Schițați spectrul, având în vedere că vanadiul are spin nuclear I = 7/2.
- estimați că acest compus nu funcționează.
compusul reacționează cu N2, formând un dimer cu punte N2.
e) desenați structura acestui produs.
f) acest compus nu produce spectru EPR. Furnizați o structură de rezonanță a (e) care explică această observație.
răspuns
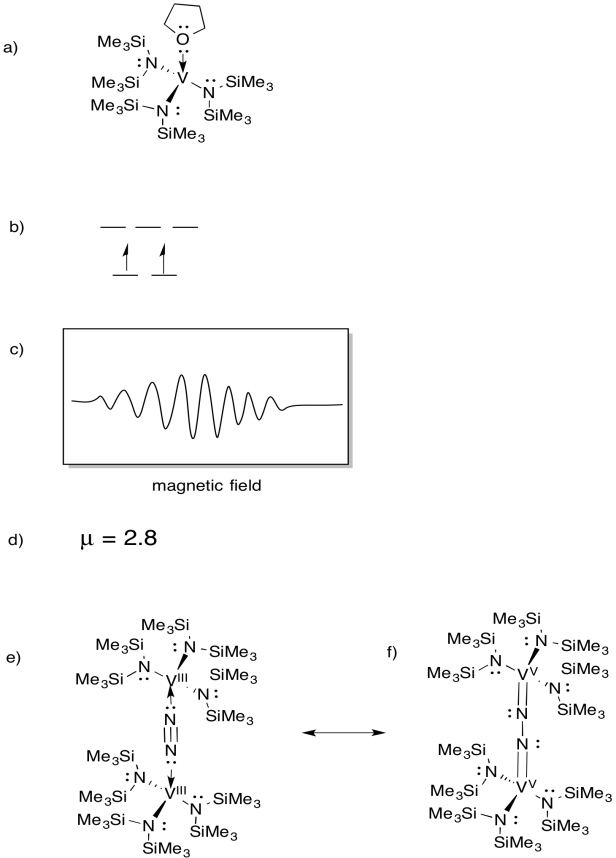
spectrele EPR furnizate prin amabilitatea imaginației virtuale / creațiilor de Chimie Slapdash.
atribuire
Chris P Schaller, Ph. D., (Colegiul Saint Benedict / Universitatea Saint John)