there are experimental methods for the detection of unpaired electrons. Uma das características dos elétrons não emparelhados nos materiais é a interação com um campo magnético. Essa interação pode ser usada para fornecer informações sobre compostos que contêm elétrons não emparelhados.
ressonância paramagnética eletrônica
ressonância paramagnética eletrônica (EPR) ou ressonância eletron spin (ESR) é um método espectroscópico. Depende da separação energética de dois estados de spin que existe apenas na presença de um campo magnético.
EPR é muito estreitamente relacionado com outro tipo comum de espectroscopia de ressonância do spin, NMR.
Spin é uma propriedade quântica que não tem nenhuma analogia real que faria sentido para nós em um nível macroscópico. No entanto, sabemos que o spin tem associado a ele Propriedades magnéticas. Um elétron pode ter qualquer um dos dois valores para estas propriedades magnéticas. Existem várias etiquetas dadas a estes valores: às vezes” para cima “e” para baixo”, às vezes, +1/2 e -1/2. No entanto, o valor de spin que um elétron possui não faz diferença energeticamente.
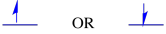
os dois possíveis estados de spin são os mesmos energeticamente — a menos que esteja presente um campo magnético. Uma vez que essa situação surge, há uma separação enérgica entre os dois estados.
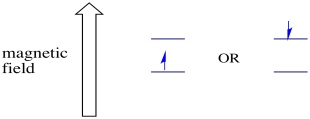
na presença de um campo magnético, os dois estados de rotação separam-se em dois níveis de energia diferentes. A quantidade de separação entre os níveis de energia depende da magnitude do campo magnético. Quanto mais forte for o campo magnético, maior será a separação.
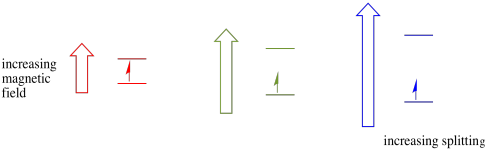
este caso só é verdadeiro para spins não emparelhados. Lembrem-se, as voltas não emparelhadas interagem com um campo magnético. Se tudo estiver emparelhado, nada acontece. Isso é muito útil, porque nos dá uma maneira de detectar esses elétrons não emparelhados.um elétron em um estado de spin ainda pode ser excitado para o outro pela absorvância de um fóton. Alternativamente, um elétron no estado superior pode cair para o mais baixo se liberar um fóton.
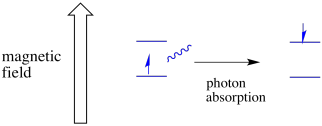
para que isso aconteça, a energia do fóton deve corresponder exatamente à diferença de energia entre Estados. Esta regra da Cachinhos Dourados é chamada de condição de ressonância. A quantidade de energia fornecida para saltar de um nível de energia para o próximo tem de estar certa. Pouca energia e o electrão não vai conseguir. Demasiada energia e o electrão também não vai conseguir. Está à espera do fotão certo.
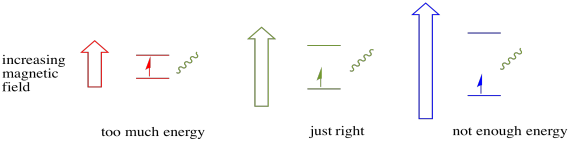
quanta energia tem um fóton? Lembra-te da tua relação Planck-Einstein. Ele descreveu a energia de um fóton:
\(E=h \nu \)
E é a energia do fóton, h é a constante de Planck (6.625 x 10-34 Js) e ν é a freqüência do fóton (parece um Romano vee, mas é a letra grega, nu).em alternativa, devido à relação entre comprimento de onda e frequência:
\(E= \ frac{HC}{\lambda}\)
As novas quantidades são c, a velocidade da luz (3.0 x 108 m s-1) e λ, o comprimento de onda do fóton.
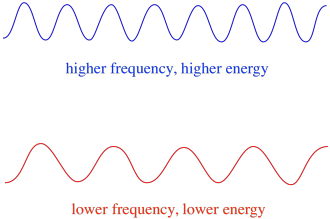
assim, em geral, diferentes comprimentos de onda da luz fornecem diferentes quantidades de energia. A luz azul, com um comprimento de onda próximo de 475 nm, tem mais energia do que a luz vermelha, com um comprimento de onda próximo de 700 nm.em EPR, a gama geral de radiação eletromagnética, ou o tipo geral de fóton, é a radiação de microondas. A frequência destes fótons é de cerca de 9 ou 10 GHz. (Another type of spectroscopy, rotational spectroscopy, also measures the absorbance of microwaves. Ele normalmente usa frequências um pouco mais altas de microondas. A espectroscopia rotacional dá informações estruturais ou de ligação sobre moléculas na fase gasosa.)
dependendo do ambiente do elétron não emparelhado, ele pode ser mais suscetível ou menos suscetível à influência do campo magnético externo. Isso significa que a divisão de energia entre os dois estados de spin vai variar de uma molécula para outra. Como resultado, moléculas diferentes no mesmo campo magnético absorveriam diferentes comprimentos de onda da radiação de microondas.
Usually, an EPR spectrometer is designed so that it supplies a fixed wavelength of microwave radiation to the sample. O campo magnético é ajustado e o instrumento mede a intensidade de campo necessária para a absorção dos fótons. Um espectro EPR mostra absorvância em função da força do campo magnético.
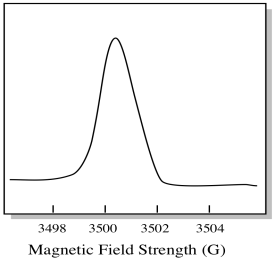
há algo um pouco diferente sobre como espectros EPR são geralmente exibidos. É apresentado como uma derivada da parcela mostrada acima. Isto deve-se à forma como o instrumento mede a variação da absorvância à medida que muda o campo magnético; ou seja, mede d(absorvância)/d(campo magnético). É a inclinação do terreno anterior.
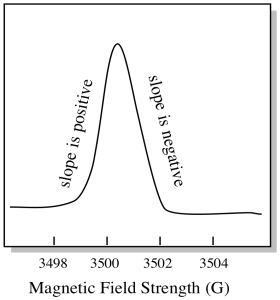
como resultado, um espectro EPR realmente se parece mais com isso. A parte acima da linha de base reflecte o declive positivo da parcela anterior. A parte abaixo da linha de base reflecte o declive negativo da parcela anterior.
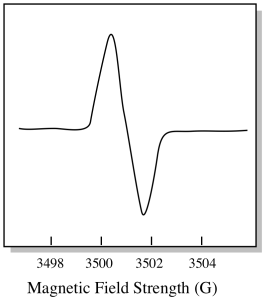
a intensidade do campo magnético não é tipicamente o valor que é relatado para a posição de pico. Em vez disso, algo chamado valor-g é relatado. The g-value arises from the equation for the Zeeman effect (the effect of the magnetic field on the splitting between spin energy levels). Que relação é:
\(\Delta E = g \beta B\)
em que ΔE é a diferença de energia entre os estados de spin, g é o valor g, uma constante de proporcionalidade que depende de como susceptíveis de o elétron é a influência do campo magnético, β é o magneton de Bohr (9.274 x 10-24 J T-1) e B é o campo magnético aplicado.
isto significa Que, por absorção de fótons,
\(h \nu = g \beta B\)
assim
\(g = \frac{ h \nu}{\beta B}\)
Lembre-se, h e β são apenas constantes. Isso significa que g é uma medida da razão entre o fóton absorvido e o campo magnético utilizado. É um passo de normalização. Se as pessoas têm instrumentos que usam comprimentos de onda ligeiramente diferentes de radiação de microondas, então os campos magnéticos que medem para as mesmas amostras não concordariam. Se todos medirem a relação de comprimento de onda com a força de campo, deve estar tudo nivelado. O valor g é uma medida reprodutível do ambiente de um elétron que deve ser o mesmo de um laboratório para outro.
uma prática semelhante é usada na espectroscopia NMR, por razões semelhantes. Quando relatamos uma mudança química em ppm em vez de Hz, estamos corrigindo para a força do campo magnético no instrumento que estamos usando. Caso contrário, a mesma amostra daria dois turnos diferentes em dois instrumentos diferentes.o acoplamento em EPR é um fenômeno no qual campos magnéticos interagem entre si. In EPR, coupling comes about because of the influence of nearby nuclei on the electron that is being observed.
Por exemplo, você já pode saber que o núcleo de um átomo de hidrogênio tem uma rotação não emparelhada. Essa é a base da espectroscopia de 1H NMR. Se esse núcleo tem um spin não emparelhado, tem um campo magnético associado. Como o núcleo de hidrogênio pode ter tanto o valor de spin, +1/2 ou -1/2, então ele tem dois possíveis campos magnéticos associados a ele.
um elétron próximo, colocado em um campo magnético externo, Poderia agora estar em qualquer uma das duas situações diferentes. Ou o protão vizinho adiciona um pouco ao campo magnético, ou subtrai um pouco do campo externo.
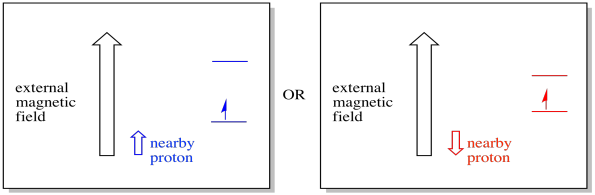
Como resultado, o elétron pode experimentar dois campos diferentes. Lembrem-se, não estamos a lidar com uma única molécula na espectroscopia. Estamos a lidar com um grande número de moléculas. Algumas das moléculas estarão em uma situação. Algumas das moléculas estarão na outra situação. Veremos ambas as situações. Haverá absorvância em duas forças diferentes do campo magnético.

Como resultado, o espectro de EPR mostra dois picos, como este:
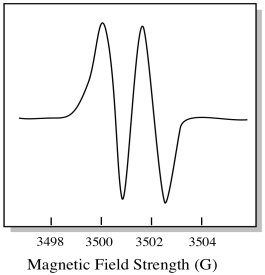
Este tipo de pico no espectro é chamado de duplo, devido à dupla absorvância. Esta característica de um pico EPR é chamada de sua multiplicidade. Em quantas linhas está o pico dividido? Dois. É um duplo.
As coisas são ainda mais interessantes se houver dois protões próximos. Nesse caso, ambos os protões vizinhos têm rotação. Ou o spin pode ter valor + 1/2 ou -1 / 2. Talvez sejam ambos + 1/2. Talvez sejam ambos -1/2. Talvez haja um de cada. Estas três combinações possíveis terão três efeitos diferentes no campo magnético experimentado pelo elétron.
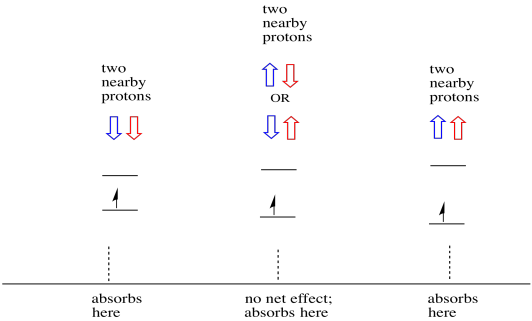
Como resultado, existem três picos no espectro. O espectro é chamado de tripleto. Este tripleto é mostrado abaixo, sob o diagrama que ilustra as combinações de spin dos hidrogénios vizinhos.
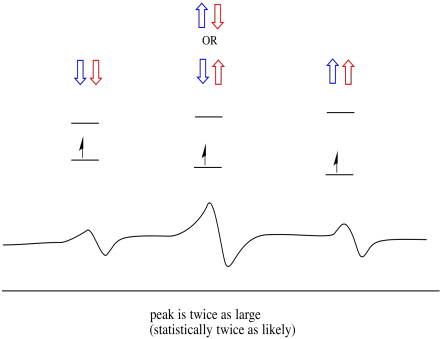
Observe que, porque hidrogênio pode ser para cima ou para baixo na mistura de combinação, há duas maneiras de chegar nesse estado intermediário. Essa combinação é duas vezes mais provável do que as outras duas, porque só há uma maneira de obter essa combinação: ambos os ângulos de hydrogens estão para cima, em um caso. Ambos os hidrogénios estão em baixo no outro. Como resultado, o pico médio em um tripleto é duas vezes maior que os picos nas bordas.
exercício \(\PageIndex{1}\)
mostram que, com três hidrogénios vizinhos, resultaria um quarteto, no qual as razões dos picos são 1:3:3:1.
Resposta
as associações são:
um) todos os gira para baixo (e só há uma maneira de fazer isso)
b) dois dos spins são para baixo, é (e cada um dos três prótons poderia ser, então existem três maneiras de fazer isso)
c) dois dos spins são para cima, mas para baixo (e cada um dos três prótons pode ser para baixo, assim, existem três maneiras de fazer isso)
d) todas as rodadas (e há apenas uma maneira de fazer isso).
o resultado é um quarteto 1: 3: 3: 1.
Exercício de \(\PageIndex{2}\)
Prever a multiplicidade no espectro de EPR para cada um dos seguintes alkoxy radicais (observe que o oxigênio e o carbono tem nenhuma spins desemparelhados; suponha que o mesmo é verdadeiro para X):
a) X3C-O. b) X2CH-O. c) XCH2-O. d) CH3-O.
a Resposta)
a) singlet
a Resposta b)
b) gibão
a Resposta c)
c) tripla
a Resposta d)
d) quarteto
Exercício de \(\PageIndex{3}\)
Suponha que o benzeno foram reduzidos por um elétron para obter o benzeno radical anião. Qual seria a multiplicidade no espectro EPR?Resposta 1:3:5:7:5:3:1 ).
Acoplamento a iões metálicos
lotes de núcleos, com excepção do hidrogénio, têm uma rotação líquida. Se o elétron não emparelhado for encontrado em um metal, o espectro EPR pode fornecer a confirmação dessa informação estrutural. Esta confirmação pode vir tanto da Informação do campo magnético (semelhante ao deslocamento químico em NMR) quanto da multiplicidade.apresentam-se a seguir as espiras nucleares de Metais seleccionados.
| Metal | Rotação |
| V | 7/2 |
| Mn | 5/2 |
| Fe | 0 |
| Co | 7/2 |
| Cu | 3/2 |
Em cada um desses metais, o núcleo tem diferentes possibilidades de campos magnéticos. Note que seus efeitos são ligeiramente mais complicados do que os de um átomo de hidrogênio. Por exemplo, o cobre, com spin 3/2, age um pouco como três núcleos de hidrogênio diferentes (cada um com spin +/- 1/2) em termos de seu efeito no espectro EPR de um eletrom próximo. A multiplicidade de um elétron não emparelhado em um íon de cobre deve ser bastante distintiva.
Exercício de \(\PageIndex{4}\)
Prever a multiplicidade de um pico no espectro de EPR para um ímpar de elétrons em cada um dos seguintes metais:
a) vanádio b) manganês c) ferro d) cobalto e) de cobre
Resposta a)
a) um octeto (em um 1:3:5:7:7:5:3:1 ratio)
a Resposta b)
b) um sexteto (na 1:3:5:5:3:1 razão)
resposta C)
C) um singlet
resposta D)
D) um octeto
resposta E)
E) um quarteto (numa razão de 1:3:3:1)
por vezes as coisas são mais complicadas, porque diferentes isótopos do mesmo elemento podem ter diferentes valores de spin possíveis. De fato, isso é verdade com hidrogênio e carbono, mas a grande maioria do hidrogênio é encontrada como 1H, então em geral podemos pensar que ele tem spin = 1/2; a grande maioria do carbono é 12C, com spin = 0.
os isótopos naturais do ferro, e suas rotações nucleares, são mostrados na tabela abaixo.
| Isotope | Spin | % Abundance |
| 54Fe | 0 | 5.9 |
| 56Fe | 0 | 91.8 |
| 57Fe | 1/2 | 2.1 |
| 58Fe | 0 | 0.2 |
The EPR spectrum of an unpaired electron on iron may be slightly more complicated than we first thought. Dentro da amostra, alguns dos elétrons estariam situados em íons de ferro com spin = 1/2, embora a maioria não estaria. Esta complicação pode ser suficiente para introduzir uma ligeira variação na aparência do espectro, mas no geral ainda seria muito parecido com um singlet.
no entanto, em muitos casos as coisas ficam muito mais complexas. Molibdênio fornece um bom exemplo.
| Isótopo | Rotação | % Abundância |
| 92Mo | 0 | 14.8 |
| 94Mo | 0 | 9.3 |
| 95Mo | 5/2 | 15.9 |
| 96Mo | 0 | 16.7 |
| 97Mo | 5/2 | 9.6 |
| 98Mo | 0 | 24.1 |
| 100Mo | 0 |
Há sete isótopos de ocorrência natural de molibdênio. Cinco deles têm spin = 0, então um elétron não emparelhado nesses isótopos daria origem a um singlet simples no espectro EPR. Os outros dois isótopos, compreendendo 25% do total, têm spin = 5/2. A maioria dos elétrons não emparelhados em molibdênio apareceria como um único. No entanto, uma fracção significativa apareceria como sexteto. Isso significa que, em um caso ideal, um elétron não emparelhado em molibdênio daria origem a um singlet com um sexteto sobreposto sobre ele (cerca de um quarto tão forte como o singlet).esta situação pode parecer-se com o desenho abaixo.
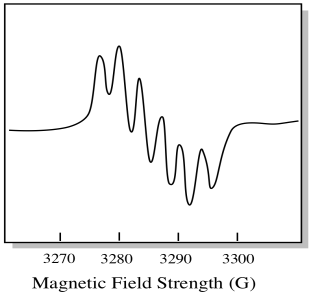
na realidade, os espectros EPR são enormemente complicados em muitos casos. Muitas vezes parecem bolhas felpudas. Há tantas coisas ligadas a tantas outras coisas que se torna quase impossível decifrar por olho. Na maioria dos casos, simulações de computador são executadas e os dados experimentais são comparados com as simulações de computador para obter insights estruturais.
exercício \(\PageIndex{5}\)
vanádio está presente em algumas nitrogenases e, por isso, tem havido interesse em complexos de modelos (por exemplo, Sandro Gambarotta et al, J. Am. Chem. Soc. 1994, 116, 6927-6928). O Gambarotta utilizou a seguinte síntese, no solvente THF::
\(\ce{VCl3 + K -> 3V (THF)}\)
- Desenhar a estrutura do produto da reação.
- desenhe um diagrama de divisão orbital d para este complexo.foi registado um espectro EPR para este composto. Sketch the spectrum, given that vanadium has nuclear spin I = 7/2.
- estimar µeff para este composto.
o composto reage com N2, formando um dímero de N2.
E) Desenhar a estrutura deste produto.
f) Este composto não produz espectro EPR. Fornecer uma estrutura de ressonância de (e) que explique esta observação.
resposta
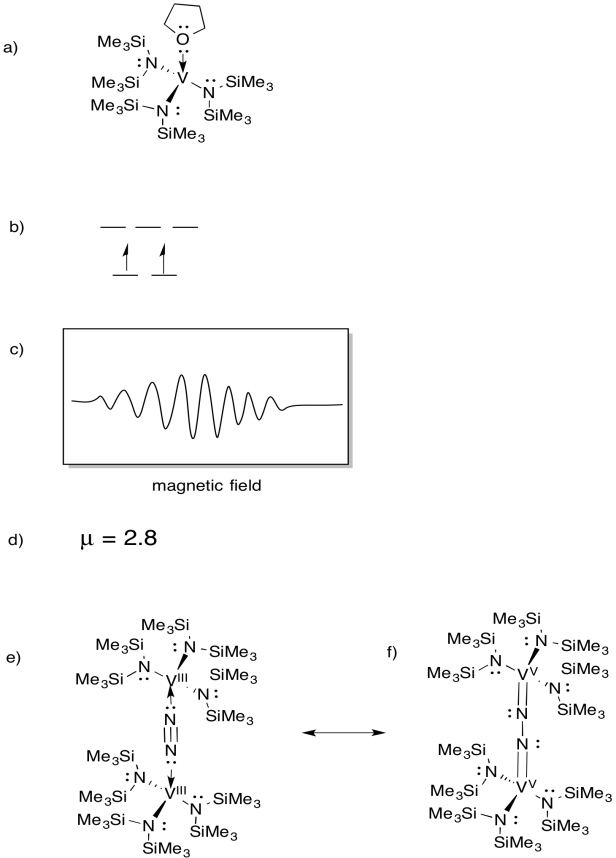
EPR spectra provided courtesy of Virtual Imagination / Slapdash Chemistry Creations.
atribuição
Chris P Schaller, Ph. D., (College of Saint Benedict/Saint John’s University)