- Introduction
- Matériaux et méthodes
- Analyse instrumentale
- Des cultures microbiennes
- Préparation du milieu
- La fermentation de l’Énanthate de Drostanolone (1) avec C. aphidicola ATCC 28300, et F. lini NRRL 2204
- 2α-Méthyl-3α,14α, 17β-trihydroxy-5α-androstane(2)
- 2α-Méthyl-7α-hydroxy-5α-androstan-3,17-dione(3)
- 2α-Méthyl-3α, 17β-dihydroxy-5α-androstane(4)
- 2-Méthylandrosta-1,4-diène-3,17-dione (5)
- 2-Méthylandrosta-11α-hydroxy-1,4-diène-3,17-dione (6)
- 2-Méthylandrosta-14α-hydroxy-1,4-diène- 3,17-dione(7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- Résultats et discussion
- Élucidation de la structure
- Cytotoxicité contre le cancer HeLa, PC3, H640 et HCT116 et les lignées cellulaires normales 3T3
- Relation structure-activité
- Conclusion
- Contributions des auteurs
- Déclaration sur les conflits d’intérêts
- Remerciements
- Matériel supplémentaire
Introduction
La transformation microbienne est l’une des approches les plus importantes pour la transformation structurelle de diverses classes de composés organiques. Cette technique a été utilisée avec succès en chimie verte, i.e. les programmes de découverte et de développement de médicaments, fournissant une excellente source de composés autour des structures centrales, suivis d’un dépistage de diverses activités biologiques. Dans plusieurs cas, la transformation microbienne a été utilisée comme un outil important pour les conversions régio-, chimio- et stéréo-sélectives de composés organiques difficiles à réaliser par des méthodes conventionnelles (Holland et Weber, 2000; Fernandes et al., 2003; Mihovilovic et coll., 2003; Yildirim et coll., 2003; Bartmanska et coll., 2005; Borges et coll., 2009; Choudhary et coll., 2011; Ravindran et coll., 2012). En raison de la nature inactive du squelette hydrocarboné des stéroïdes, il est souvent difficile de les dériver par des méthodes de synthèse conventionnelles. Par conséquent, la transformation microbienne est souvent utilisée pour l’altération structurelle des stéroïdes. La présence de systèmes enzymatiques cytochromes P450 dans les champignons fait de la biocatalyse à cellules entières un outil efficace pour l’hydroxylation stéréo et spécifique à la région (Choudhary et al., 2005a; Tong et Dong, 2009; Kristan et RiŽner, 2012; Baydoun et al., 2014).
La Drostanolone et ses dérivés d’esters, tels que le propionate de drostanolone, le pentanoate de drostanolone et l’énanthate de drostanolone (1) sont des stéroïdes anabolisants androgènes (AASs) utilisés par les athlètes pour renforcer leurs muscles sans gagner de graisse. De plus, la drostanolone et ses dérivés esters ont la capacité d’inhiber la production d’œstrogènes. L’ester de propionate de drostanolone est également utilisé pour le traitement du cancer du sein, sous la marque Masteron (Chowdhury et al., 1976; Clavel et coll., 1982; Marinov et coll., 1986; Vardar et coll., 2002; Bahrke et Yesalis, 2004).
Le cancer est actuellement reconnu comme un défi majeur de santé publique. Les cancers sont la deuxième cause de décès aux États-Unis et partout dans le monde. Selon l’Organisation mondiale de la Santé (OMS), la prévalence du cancer dépasse les 6 millions de cas par an. Les cellules cancéreuses ont un taux de prolifération élevé. Ils se propagent rapidement dans le système vivant et peuvent survivre contre de fortes chimiothérapies et des agents dommageables pour l’ADN. De même, les médicaments cytotoxiques ont de nombreux effets indésirables sur les cellules normales, et leur utilisation en chimiothérapie anticancéreuse est donc un défi thérapeutique. Pour cette raison, le développement d’agents chimiothérapeutiques sûrs, efficaces et sélectifs est urgent contre divers cancers (Munoz-Pinedo et al., 2012; Su et coll., 2015; Swadogo et coll., 2015; Rebecca et coll., 2016).
Le cancer du sein est l’un des cancers les plus courants dans 140 pays du monde. C’est une cause majeure de décès liés au cancer chez les femelles partout dans le monde, caractérisée par la croissance anormale des cellules dans les lobules ou les canaux mammaires avec un taux de prolifération élevé (Hanahan et Weinberg, 2000; Ferlay et al., 2015).
Le cancer du col utérin est le deuxième cancer le plus prédominant chez les femmes dans le monde, après le cancer du sein. La principale cause du cancer du col de l’utérus est la formation de cellules malignes dans les tissus du col de l’utérus (Wang et al., 2013; Hafiza et Latifah, 2014; Pariente et al., 2016). La lignée de cellules cancéreuses HeLa, obtenue à partir de cellules cancéreuses du col utérin humain, est un modèle cellulaire courant pour évaluer le potentiel cytotoxique des composés testés.
Le cancer de la prostate est le deuxième cancer chez l’homme dans le monde après le cancer des bronches, et la troisième cause de décès par cancer la plus fréquente. C’est la raison la plus fréquente de malignité chez les hommes. Son incidence augmente avec l’âge, plus fréquente au-delà de 50 ans (Henry et Omahony, 1999; De-Bono et al., 2010; Wenbin et coll., 2015). La lignée de cellules cancéreuses PC-3, obtenue à partir de cellules cancéreuses de la prostate mâles, est un modèle largement utilisé pour étudier la toxicité des composés testés.
Le cancer du poumon est un cancer très répandu chez les hommes aux États-Unis depuis le milieu des années 1950 et chez les femmes depuis la fin des années 1980. C’est l’une des principales causes de décès liés au cancer. Le cancer du poumon est principalement attribué au tabagisme (Travis et al., 2002; Villanti et coll., 2013; Mishra et coll., 2016). La lignée de cellules cancéreuses H460, obtenue à partir de cellules cancéreuses du poumon humain (sous-lignée métastatique lymphogène du carcinome pulmonaire à grandes cellules humaines), est souvent utilisée pour évaluer la cytotoxicité des composés testés.
Après les cancers du sein, du poumon et de la prostate, le cancer du côlon est le quatrième cancer le plus répandu dans le monde. C’est le cancer trouvé à une fréquence à peu près égale chez les hommes et les femmes. C’est la deuxième cause la plus fréquente de décès liés au cancer dans les pays occidentaux (Levin et al., 2008; André et coll., 2009; Ahearn et coll., 2012). La lignée de cellules cancéreuses HCT116, obtenue à partir de cellules cancéreuses du côlon humain, est couramment utilisée pour évaluer la cytotoxicité des composés testés.
Dans le prolongement de nos études sur la transformation fongique des stéroïdes bioactifs (Choudhary et al., 2005b, c, 2007, 2010; Ahmad et coll., 2014; Siddiqui et coll., 2017), nous avons synthétisé des analogues de l’énanthate de drostanolone (1) par sa transformation avec Cephalosporium aphidicola et Fusarium lini. Les métabolites 2-9, ainsi que le substrat 1, ont été évalués par rapport aux lignées cellulaires HeLa (carcinome cervical), PC-3 (carcinome de la prostate), H460 (cancer du poumon), HCT116 (cancer du côlon) et 3T3 (fibroblastes de souris normaux), en utilisant un dosage cellulaire à haut débit, la méthode de laboratoire la plus efficace et la plus pratique, le test MTT pour prédire la réponse des composés testés dans les tumeurs malignes où ils ont montré une spécificité par rapport aux cellules cancéreuses. Cette étude a ainsi identifié des métabolites anticancéreux de l’énanthate de drostanolone (1) pour des études ultérieures.
Matériaux et méthodes
Analyse instrumentale
La chromatographie sur couche mince (CCM) (gel de silice, 20 × 20, 0,25 mm d’épaisseur, PF254, Merck, Allemagne) a été utilisée pour l’analyse du degré de transformation et de la pureté. La chromatographie sur colonne de gel de silice (maille 70-230, E. Merck, Allemagne) a été utilisée pour la purification initiale des métabolites. De plus, le recyclage préparatif en phase inverse (JAI LC-908W, Japon), équipé de YMC L-80 (4-5 µm, 20-50 mm i.d.), a été utilisé pour la purification finale des métabolites. Les structures des métabolites ont été élucidées à l’aide de spectres 1H- (400, 500 et 600 MHz) et 13C-RMN (100, 125 et 150 MHz), qui ont été enregistrés sur les spectromètres Bruker Avance-RMN (France) en CD3OD, CD3COCD3 ou DMSO-d6. Les spectres HREI-MS et IR ont été réalisés sur le spectromètre de masse JEOL JMS-600H (Japon) (analyseur de masse à secteur magnétique à double focalisation) (EI, ionisation par impact électronique) et le spectrophotomètre Bruker Vector 22 FT-IR, respectivement. Les rotations optiques des métabolites ont été enregistrées sur le polarimètre JASCO P-2000 (Japon). Le spectrophotomètre UV-visible Evolution 300 a été utilisé pour enregistrer les spectres UV. Les points de fusion des produits transformés ont été mesurés à l’aide de l’instrument Buchi M-560 (Suisse). Les données de diffraction des rayons X monocristallins ont été collectées sur le diffractomètre Bruker APEXII D8 Venture, équipé d’un détecteur PHOTON 100 (technologie CMOS) et d’un tube scellé à foyer fin ayant une source de rayons X (radiations Cu Ka α = 1,54178 Å). Les intensités de réflexion ont été intégrées à l’aide du logiciel SAINT. La correction d’absorption a été effectuée sur balayage multiple et la structure a été résolue par le programme SHELXTL (Gerlier et Thomasset, 1986; Sheldrick, 2008; Spek, 2009).
Des cultures microbiennes
Des cultures microbiennes de C. aphidicola ATCC 28300 et de F. lini NRRL 2204 ont été obtenues de l’American Type Culture Collection (ATCC) et des Laboratoires de recherche régionaux du Nord (NRRL), respectivement. Des cultures ont été cultivées sur gélose Sabouraud dextrose (SDA) inclinée, et maintenues à 4°C.
Préparation du milieu
Quatre litres de milieu pour la croissance de C. aphidicola ATCC-28300 ont été préparés en mélangeant 200 g de glucose, 4 g de KH2PO4, 8 g de glycine, 4 g de KCl, 8 g de MgSO4.7H2O, et 8 mL d’oligo-éléments dans 4 L d’eau distillée. De même, quatre litres de milieu ont été préparés pour F. lini NRRL 2204 en mélangeant 40 g de glucose, 20 g d’extrait de levure, 20 g de peptone, 20 g de KH2PO4, 20 g de NaCl et 40 mL de glycérol dans 4 L d’eau distillée.
La fermentation de l’Énanthate de Drostanolone (1) avec C. aphidicola ATCC 28300, et F. lini NRRL 2204
Milieu de croissance de C. aphidicola et F. lini a été préparée en mélangeant les ingrédients précités dans 4 L d’eau distillée pour chaque champignon, qui a ensuite été distribué à parts égales dans 40 flacons Erlenmeyer de 250 mL (100 mL dans chaque flacon). Tous ces flacons ont été autoclavés à 121 °C, et ont été inoculés avec des inclusions SDA de C. aphidicola ATCC 28300 et F. lini NRRL 2204 dans des conditions stérilisées. Ces flacons contenant des cultures fongiques ont été laissés sur l’agitateur rotatif (121 tr/min) à 26 ± 2 °C pendant 3-4 jours pour obtenir une croissance maximale de C. aphidicola et F. lini. Le composé 1 (1 g) a été dissous dans 20 mL d’acétone pour chaque champignon, et a été distribué 0,5 mL dans chaque flacon, puis placé à nouveau sur un agitateur rotatif pendant 12 jours. Un témoin négatif (milieu + culture fongique), ainsi qu’un témoin positif (milieu + substrat) ont également été préparés de manière analogue pour évaluer les métabolites fongiques et la dégradation du composé 1, respectivement. Après 12 jours d’incubation, tous les flacons ont été filtrés et extraits avec 20 L de dichlorométhane (DCM), la phase organique a été séparée, puis évaporée sous pression réduite sur évaporateur rotatif. On obtient ainsi 1,5 g de brut solide jaunâtre pâle. Ce matériau brut a été fractionné sur chromatographie sur colonne de gel de silice par élution avec des systèmes de solvants hexanes à gradient et acétone. La chromatographie sur colonne a donné quatre fractions principales (1-4), qui ont ensuite été purifiées par recyclage HPLC. Les métabolites 2 (tR = 16 min, 8 mg, 0,8%), 3 (tR = 19 min, 11 mg, 1,1%), 4 (tR = 17 min, 35 mg, 3,5 %), 5 (tR = 23 min, 42 mg, 4,2 %), 6 (tR = 20 min, 9 mg, 0,9 %), 7 (tR = 21 min, 12 mg, 1,2 %) et 9 (tR = 18 min, 5 mg, 0,5%) étaient purifié à partir des fractions 1 à 7, respectivement, par HPLC de recyclage en phase inverse en utilisant du méthanol-eau comme système de solvant (MeOH: H2O; 70: 30). Considérant que le métabolite 8 a été obtenu à partir de la fraction 8 par HPLC de recyclage en phase normale (tR = 32 min, CHCl3: MeOH; 95:5, 7.5 mg, 0,75%).
2α-Méthyl-3α,14α, 17β-trihydroxy-5α-androstane(2)
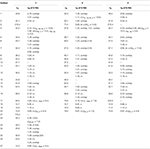
Tableau 1. Données de déplacement chimique RMN 13C et 1H (J et W1/2 en Hz) des composés 1-3 (δ ppm).
2α-Méthyl-7α-hydroxy-5α-androstan-3,17-dione(3)
2α-Méthyl-3α, 17β-dihydroxy-5α-androstane(4)
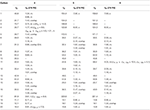
Tableau 2. Données de déplacement chimique RMN 13C et 1H (J et W1/2 en Hz) des composés 4-6 (δ ppm).
2-Méthylandrosta-1,4-diène-3,17-dione (5)
2-Méthylandrosta-11α-hydroxy-1,4-diène-3,17-dione (6)
2-Méthylandrosta-14α-hydroxy-1,4-diène- 3,17-dione(7)
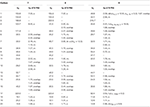
Tableau 3. Données de déplacement chimique RMN du 13C et du 1H (J et W1/2 en Hz) des composés 7-9 (δ ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. Des lignées cellulaires ont été cultivées dans un milieu DMEM F12, additionné de 10% de FBS sous atmosphère de CO2 à 5% à 37°C dans un incubateur.
Le test colorimétrique MTT a été utilisé pour l’évaluation de l’activité métabolique cellulaire. Dans ce test, le MTT jaune est réduit en formazon violet dans les mitochondries des cellules vivantes (Gerlier et Thomasset, 1986). Plus il y a de cellules vivantes, plus la couleur et donc plus l’absorbance est observée par colorimètre (Fesahat et al., 2015). Nous avons utilisé cette méthode pour analyser l’effet de nos produits transformés sur la cytotoxicité cellulaire contre les cellules cancéreuses. Environ 10 000 cellules de chaque lignée cellulaire (cancers HeLa, PC3, H460, HCT116 et 3T3 normal) ont été ensemencées dans des plaques à 96 puits. Après avoir atteint une confluence de 80 à 90%, ils ont été traités avec diverses concentrations de composés (25, 50, 75, 100 et 200 µM) pendant 24 h. Tous les composés ont été dissous dans du DMSO stérile pour former une solution mère de 200 mM. La solution a été filtrée et des dilutions en série ont été effectuées en milieu de croissance. 600 µL de chaque dilution ont été utilisés pour traiter 3 puits (triplicate de chacun) de plaque de 96 puits soit 200 µL chacun. Chaque expérience a été réalisée en trois répliques biologiques. Le MTT a été ajouté et incubé pendant 4 h. Après élimination du MTT, les cristaux de formazon violet ont été dissous dans du DMSO et une lecture a été observée à 540 et 570 nm pour les cellules normales et cancéreuses, respectivement. Le lecteur Multiskan donne λmax à 540 nm dans des cellules de fibroblastes 3T3 traitées au DMSO (qui sont plus confluentes dans la morphologie) alors que dans le cas de cellules cancéreuses, 570 nm donne λmax (Bonmati-Carrion et al., 2013; Danihelová et coll., 2013). Une large gamme de lignées cellulaires de carcinome épithélial a été utilisée dans cette expérience où le cisplatine était un médicament de choix courant. Il cible l’ADN, interfère avec la division cellulaire pendant la mitose et induit l’apoptose (Eastman, 1999). Les valeurs de la CI50 ont été calculées pour déterminer la concentration minimale requise pour tuer 50% des cellules.
Alors que,
At= Valeur d’absorbance du composé d’essai
Ab = Valeur d’absorbance de l’ébauche
Ac = Valeur d’absorbance du témoin
Résultats et discussion
Élucidation de la structure
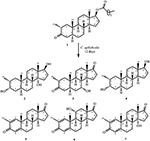
Figure 1. Biotransformation de l’énanthate de drostanolone (1) avec Cephalosporium aphidicola.
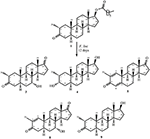
Figure 2. Biotransformation de l’énanthate de drostanolone (1) avec Fusarium lini.
Le métabolite 2 a été isolé sous forme de cristaux blancs. La formule moléculaire C20H30O3 était basée sur HREI-MS qui montrait la at m/z 322,2517 (calcd. 322.2508, C20H34O3), suggérant l’ajout de trois atomes d’hydrogène et d’oxygène, la réduction du carbonyle cétonique en C-3 et le clivage hydrolytique de la chaîne latérale de l’heptanoate dans le substrat 1. L’absorbance IR à 3 531 et 3 423 cm-1 était due à la présence de groupes hydroxyles. Le spectre RMN 1H a montré un signal supplémentaire de proton de méthine à δ 3,69 (Tableau 1) (Fiche technique 2). Les signaux pour la chaîne latérale de l’heptanoate ont également été trouvés manquants dans le spectre RMN-1H du composé 2. Le spectre RMN 13C a montré des signaux pour un nouveau carbone méthine à δ 71,4 et un nouveau carbone quaternaire à δ 84,8. Des signaux carbonés pour la chaîne heptanoate et le carbonyle cétonique ont également été trouvés manquants dans le spectre RMN du 13C. Cela suggère une réduction du carbonyle en C-3, une perte hydrolytique de la chaîne heptanoate et l’ajout d’un OH en C-14 (tableau 1). Le groupe OH a été placé en C-3 sur la base des corrélations HMBC de H3-20 (δ 0,91, d) avec C-3 (δ 71,4) (Figure 3). Ceci résulte de la réduction du carbonyle en C-3. Un deuxième groupe OH a été placé en C-14, sur la base de la corrélation HMBC de H3-18 (δ 0,81,s) avec C-14 (δ 84,8). Le troisième OH était à C-17, résultant de la perte hydrolytique de la fraction heptanoate. Le groupe O-H en C-3 a été déduit comme étant orienté α sur la base des corrélations NOESY de H-3 (δ 3,69, br. s) avec H-2 orienté β (δ 1,64, chevauchement) et H3-20 orienté α (δ 0,91, d) (Figure 4). L’OH-14 a été déduit comme étant orienté α, sur la base des corrélations NOESY de H-9 (δ 1,32,m) avec OH-14 (δ 2,66,s) (acétone-d6). L’analyse par diffraction des rayons X monocristallins a également soutenu la structure du métabolite 2, composé de trois cycles en conformation de chaise (A, B et C) et d’un en conformation d’enveloppe (D). Trois groupes OH en C-3, C-14 et C-17 ont été assignés, l’orientation α-, α- et β (figure 5). Les données de diffraction monocristalline du métabolite 2 ont été soumises à la Collecte de données cristallographiques de Cambridge (CCDC 1500706). La structure du métabolite 2 a donc été déduite comme 2α-méthyl-3α, 14α, 17β-trihydroxy-5α-androstane.
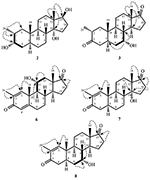
Figure 3. Corrélations clés HMBC (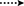 ) et COSY (
) et COSY ( ) dans les nouveaux métabolites.
) dans les nouveaux métabolites.
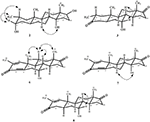
Figure 4. Corrélations NOESY clés dans les nouveaux métabolites.
Le métabolite 3 a été obtenu sous forme de solide blanc. Le HREI-MS affichait le at m/z 318.2192 (calcd. 318.2195, C20H30O3). Cela représente la perte de chaîne latérale de l’heptanoate et l’ajout d’un atome d’oxygène dans le substrat 1. Le spectre IR a montré des absorbances pour les carbonyles OH (3 436 cm−1) et cétoniques (1 711 cm−1). Dans le spectre RMN du 1H, des signaux de chaîne d’heptanoate et de proton de méthine en C-17 ont été trouvés manquants, alors qu’un nouveau signal de proton de méthine en fond de champ a été observé à δ 3,92 (Tableau 1) (Fiche technique 3). Cela suggère une hydroxylation du squelette stéroïdien et un clivage oxydatif de la fraction heptanoate. Le spectre de RMN du 13C a également soutenu les déductions ci-dessus. Les signaux de carbone pour la fraction heptanoate ont été trouvés manquants, alors qu’un nouveau signal carbonyle cétonique et un signal oxy-méthine sont apparus dans le spectre RMN du 13C (tableau 1). Ceci indique un clivage oxydatif de la chaîne heptanoate et une hydroxylation dans le substrat 1. Le proton de méthine nouvellement apparu à δ 3,92 (H-7) a montré des corrélations HMBC avec C-5 et C-8, suggérant un OH à C-7 (Figure 3). Les corrélations HMBC de H3-18 et H2-16 avec un carbone à δ 223,8 suggèrent un carbone cétonique en C-17. OH à C-7 était en outre soutenu par des corrélations CONFORTABLES de H-7 avec H2-6 et H-8. H-7 (δ 3,92, s) a montré des corrélations NOESY avec H-8 orienté axialement (δ 1,70, chevauchement), ce qui suggère une orientation α de OH en C-7 (Figure 4). Ainsi, la structure du métabolite 3 a été déduite comme 2α-méthyl-7α-hydroxy-5α-androstan-3,17-dione.
Des analyses de diffraction des rayons X monocristallins ont également été effectuées sur les composés 1 et 5. Le composé 1 était composé de quatre anneaux, c’est-à-dire A, B, C et D avec des conformations de chaise, de chaise, de chaise et d’enveloppe. Un méthyle était présent en C-2 avec une orientation équatoriale. Une chaîne d’ester d’heptanoate était présente en C-17 du cycle D (Figure 6). Considérant que le métabolite 5 contient des anneaux A, B, C et D dans les conformations de rabot, de chaise, de chaise et d’enveloppe. La chaîne latérale de l’heptanoate était absente du métabolite 5 (figure 7). Les données de diffraction monocristalline des métabolites 1 et 5 ont été soumises à la collecte de données cristallographiques de Cambridge (CCDC 1500705 et CCDC 1500707, respectivement). Les données d’analyse par diffraction des rayons X monocristallins des composés 1, 2 et 5 sont présentées dans le tableau 4.
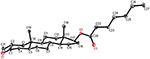
Figure 6. Dessin ORTEP généré par ordinateur du modèle radiographique final du composé 1. Codes couleurs: carbone, noir; oxygène, rouge.
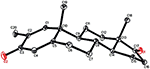
Figure 7. Dessin ORTEP généré par ordinateur du modèle radiographique final du composé 5. Codes couleurs: carbone, noir; oxygène, rouge.

Tableau 4. Analyse par diffraction des rayons X monocristallins des composés 1, 2 et 5.
Cytotoxicité contre le cancer HeLa, PC3, H640 et HCT116 et les lignées cellulaires normales 3T3
Produits naturels, par exemple, flavonoïdes, stéroïdes, terpènes, etc. peut servir d’excellente source pour la production de nombreux médicaments, car ils sont signalés pour de nombreuses activités biologiques telles que les activités anticancéreuses, anti-inflammatoires, anti-leishmaniales, antibactériennes, etc. Par conséquent, il est nécessaire de les dérivatiser, d’étudier la relation structure-activité qui pourrait être utile pour la synthèse de médicaments sûrs et efficaces. À l’heure actuelle, de nombreux produits pharmaceutiques sont synthétisés efficacement par biotransformation microbienne en raison de la présence d’une gamme d’enzymes. Sur la base de l’activité anticancéreuse rapportée de la drostanolone (9), du propionate de drostanolone et de l’heptanoate de drostanolone (1), la cytotoxicité des composés 1 à 9 a été évaluée contre les lignées de cellules cancéreuses HeLa, PC-3, H460 et HCT116. Fait intéressant, tous les composés ont montré une activité anticancéreuse modérée à puissante. L’activité anticancéreuse des composés 1 à 9 a été déduite des valeurs de la CI50 contre HeLa (carcinome cervical humain), PC-3 (cancer de la prostate humain), H460 (cancer du poumon humain) et HCT116 (cancer du côlon humain) (tableau 5). Sur la base de ces résultats, la cytotoxicité de ces composés a également été évaluée par rapport à la lignée cellulaire normale 3T3 (fibroblaste de souris), où tous les composés, sauf 8 (CI50 = 74,6 ± 3,7 µM) et 9 (CI50 = 62,1 ± 1,2 µM), se sont révélés non cytotoxiques.

Tableau 5. Cytotoxicité des composés 1-9 contre le cancer HeLa, PC3, H460 et HCT116 et les lignées cellulaires normales 3T3.
Relation structure-activité
Les variations des structures des métabolites ont affecté leur activité anticancéreuse. Le métabolite 2 avec l’absence de fraction ester, et deux groupes aO-H en C-3 et C-14, et un groupe ßO-H en C-17 ont montré une cytotoxicité inférieure contre les lignées de cellules cancéreuses HeLa, H460 et HCT116, mais son activité anticancéreuse était plus élevée contre la lignée de cellules cancéreuses PC-3, par rapport au composé 1. Le métabolite 3 avec la perte du groupe ester et de deux groupes céto en C-3, et en C-17, et le groupe aO-H en C-7 ont également montré une activité plus faible contre les lignées de cellules cancéreuses HeLa, H460 et HCT116, mais une activité accrue contre la lignée de cellules cancéreuses PC-3 par rapport au substrat 1. La réduction du carbonyle en C-3 en O-H et le clivage hydrolytique de la fraction ester dans le composé 4 ont augmenté son activité à la fois contre les lignées de cellules cancéreuses HeLa et PC-3 dans une certaine mesure, mais son activité anticancéreuse contre les lignées de cellules cancéreuses H460 et HCT116 a diminué par rapport au substrat 1. La présence de C = C entre C-1 / C-2 et C-4 / C-5, ainsi que de C = O en C-3 et en C-17 ont fait du métabolite 5 un puissant agent anticancéreux contre la lignée cellulaire cancéreuse HeLa, par rapport au substrat 1 et au médicament standard (cisplatine). De plus, son activité anticancéreuse contre la lignée cellulaire cancéreuse PC-3 a également été augmentée par rapport au substrat 1. Fait intéressant, son activité anticancéreuse contre les lignées de cellules cancéreuses H460 et HCT116 était plus faible que celle du composé 1. La présence de C = C entre C-1 / C-2 et C-4 / C-5, C = O en C-3 et C-17, ainsi que du groupe aO-H en C-11 dans le métabolite 6 a augmenté son activité anticancéreuse contre les lignées de cellules cancéreuses HeLa et PC-3 par rapport au substrat 1 et a montré un potentiel anticancéreux similaire contre la lignée de cellules cancéreuses HeLa en tant que médicament standard (cisplatine). Cependant, son activité anticancéreuse contre les lignées cellulaires cancéreuses H460 et HCT116 a diminué par rapport au composé 1. La présence de C = C entre C-1 / C-2 et C-4 / C-5, C = O en C-3 et en C-17, ainsi que du groupe aO-H en C-14 dans le métabolite 7 a de nouveau augmenté son activité anticancéreuse contre les lignées cellulaires cancéreuses HeLa et PC-3, et a diminué son activité anticancéreuse contre les lignées cellulaires H460 et HCT116 par rapport au substrat 1. La présence de C = C en C-1 / C-2, de C = O en C-3 et en C-17 et d’aOH en C-7 a fait du métabolite 8 l’anticancéreux le plus puissant contre la lignée de cellules cancéreuses HeLa par rapport au substrat 1 et au médicament standard (cisplatine). Il a également montré une bonne activité contre la lignée de cellules cancéreuses PC-3, mais une activité anticancéreuse diminuée contre les lignées de cellules cancéreuses H460 et HCT116 par rapport au substrat 1. Le métabolite 9 avec seulement une hydrolyse en C-17 a montré une activité anticancéreuse accrue contre les lignées de cellules cancéreuses HeLa, PC-3 et HCT116, mais une cytotoxicité réduite contre la lignée de cellules cancéreuses H460 par rapport au substrat 1 et au médicament standard (cisplatine). Sur la base de la discussion ci-dessus, on peut conclure que l’augmentation de l’activité anticancéreuse des composés 5-8 contre les lignées de cellules cancéreuses HeLa et PC-3 était probablement due à la présence de C = C en C-1 / C-2 et de carbonyl cétone en C-3 et en C-17 par rapport au substrat 1.
Conclusion
Contributions des auteurs
Le concept de recherche présentée a été développé et conçu par MIC. MIC était également le superviseur du projet. Toutes les données ont été analysées et interprétées par MIC, A-t-W et HC. MS, SY, MA et NF ont effectué les expériences. MIC, A-t-W et MS ont écrit le manuscrit. Tous les auteurs ont révisé le manuscrit. La version finale du manuscrit a également été approuvée par MIC avant sa soumission.
Déclaration sur les conflits d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de relations commerciales ou financières pouvant être interprétées comme un conflit d’intérêts potentiel.
Remerciements
A-t-W, et MIC reconnaissent le rôle habilitant de la Commission de l’Enseignement supérieur, Islamabad, Pakistan, à travers un soutien financier au titre de « Studies on the Chemoprévention of Mammary Carcinogenesis by Dietary Agents, (20-3790/NRPU/R&D/HEC/13/793). »SY reconnaît le soutien financier de l’OIAC (Organisation pour l’Interdiction des Armes chimiques) à travers un projet de recherche intitulé « Études structurelles et biologiques sur les nouveaux stéroïdes anabolisants obtenus par biotransformation. »HC reconnaît le soutien financier du » Décanat de la Recherche Scientifique (DSR), Université du Roi Abdulaziz, Ministère de l’Éducation, Arabie Saoudite. »
Matériel supplémentaire
Eastman, A. (1999). « Le mécanisme d’action du cisplatine: des adduits à l’apoptose », dans le cisplatine: Chimie et biochimie d’un Médicament anticancéreux de premier plan, ed B. Lippert (Zürich: Verlag Helvetica Chimica Acta), 111-134. doi:10.1002/9783906390420.ch4
CrossRef Full Text/Google Scholar
Vardar, E., Vardar, S.A. et Cengiz, T. (2002). Abus de stéroïdes anabolisants androgènes. Anato. J. Psychiatrie 3, 104-107.