- Introdução
- materiais e métodos
- análise Instrumental
- Preparação de Media
- Fermentação de propionato Drostanolone (1) com C. aphidicola ATCC 28300, e F. lini NRRL 2204
- 2α-Metil-3α,14α,17ß-trihydroxy-5α-androstano (2)
- 2α-Metil-7α-hidroxi-5α-androstan-3,17-diona (3)
- 2α-Metil-3α,17ß-di-hidroxi-5α-androstano (4)
- 2-Metilandrosta-1,4-dieno-3,17-diona (5)
- 2-Metilandrosta-11 hyd-hidroxi-1,4-dieno-3,17-diona (6)
- 2-Metilandrosta-14 hyd-hidroxi-1,4-diene-3,17-dione (7)
- 2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
- 2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
- Experimental Protocol for Cytotoxicity
- Resultados e Discussão
- Estrutura de Elucidação
- citotoxicidade contra o cancro HeLa, PC3, H640 e HCT116, e linhagens celulares normais
- relação estrutura-actividade
- Conclusion
- Author Contributions
- Declaração de conflito de interesses
- Agradecimentos
- material suplementar
Introdução
transformação Microbiana é uma das mais importantes abordagens para a transformação estrutural de várias classes de compostos orgânicos. Esta técnica tem sido empregada com sucesso em Química Verde, i.e. os programas de descoberta e desenvolvimento de drogas, fornecendo uma excelente fonte de compostos em torno das estruturas do núcleo, seguido de triagem para várias atividades biológicas. Em vários casos, a transformação microbiana tem sido usada como uma ferramenta importante para a conversão de compostos orgânicos de regio-, quimio-, e estéreo-seletivo que são difíceis de alcançar por métodos convencionais (Holland e Weber, 2000; Fernandes et al., 2003; Mihovilovic et al., 2003; Yildirim et al., 2003; Bartmanska et al., 2005; Borges et al., 2009; Choudhary et al., 2011; Ravindran et al., 2012). Devido à natureza inativa do esqueleto de hidrocarbonetos de esteróides, eles são muitas vezes difíceis de ser derivatizado por métodos sintéticos convencionais. Portanto, a transformação microbiana é frequentemente utilizada para a alteração estrutural dos esteróides. A presença de sistemas enzimáticos do citocromo P450 em fungos, faz da biocatálise de células inteiras uma ferramenta eficiente para a hidroxilação estéreo e regio-específica (Choudhary et al., 2005a; Tong and Dong, 2009; Kristan and RiŽner, 2012; Baydoun et al., 2014).a Drostanolona e os seus derivados ésteres, tais como o propionato de drostanolona, o pentanoato de drostanolona e o enantato de drostanolona (1), são esteróides anabolizantes-androgénicos (AASs) utilizados pelos atletas para fortalecer os seus músculos sem ganhar gordura. Além disso, a drostanolona, e seus derivados ésteres têm a capacidade de inibir a produção de estrogênio. O éster propionato de drostanolona também é usado para o tratamento do câncer de mama, sob a marca de Masteron (Chowdhury et al., 1976; Clavel et al., 1982; Marinov et al., 1986; Vardar et al., 2002; Bahrke and Yesalis, 2004).o cancro é actualmente reconhecido como um grande desafio para a saúde pública. Os cancros são a segunda principal causa de morte nos Estados Unidos, e em todo o mundo. De acordo com a Organização Mundial de Saúde (OMS), a prevalência de câncer é superior a 6 milhões de casos por ano. As células cancerígenas têm uma elevada taxa de proliferação. Eles se espalham rapidamente no sistema vivo, e podem sobreviver contra fortes quimioterapeutas e agentes prejudiciais ao DNA. Da mesma forma, os medicamentos citotóxicos têm muitos efeitos adversos nas células normais, e, portanto, o seu uso em quimioterapia de câncer é um desafio terapêutico. Devido a isso, o desenvolvimento de agentes quimioterapêuticos seguros, eficazes e seletivos é urgentemente necessário contra vários cancros (Munoz-Pinedo et al., 2012; Su et al., 2015; Swadogo et al., 2015; Rebecca et al., 2016).o cancro da mama é um dos cancros mais comuns em 140 países do mundo. É uma das principais causas de morte relacionada ao câncer em fêmeas de todo o mundo, caracterizada pelo crescimento anormal de células nos lobos mamários ou ductos com a alta taxa de proliferação (Hanahan e Weinberg, 2000; Ferlay et al., 2015).o cancro do colo do útero é o segundo cancro mais predominante em mulheres de todo o mundo, após o cancro da mama. A principal causa do câncer cervical é a formação de células malignas nos tecidos do colo do útero (Wang et al., 2013; Hafiza and Latifah, 2014; Pariente et al., 2016). A linha de células cancerígenas HeLa, obtida a partir de células cancerígenas do colo do útero humano, é um modelo celular comum para avaliar o potencial citotóxico dos compostos de ensaio.o câncer de próstata é o segundo maior câncer em todo o mundo após o câncer de brônquio, e a terceira causa mais comum de morte por câncer. É a razão mais comum de malignidade nos homens. Sua incidência aumenta com a idade, mais comum com a idade de 50 anos (Henry e Omahony, 1999; de-Bono et al., 2010; Wenbin et al., 2015). A linha celular de câncer PC-3, obtida a partir de células masculinas de câncer de próstata, é um modelo amplamente utilizado para investigar a toxicidade dos compostos de teste.
O câncer de pulmão é um câncer altamente prevalente entre os homens nos Estados Unidos desde meados da década de 1950 e entre as mulheres, desde o final da década de 1980. é uma das principais causas de morte relacionada ao câncer. O câncer de pulmão é principalmente atribuído ao tabagismo (Travis et al., 2002; Villanti et al., 2013; Mishra et al., 2016). A linha de células cancerígenas H460, obtida a partir de células cancerígenas do pulmão humano (sublina metastática linfóide do carcinoma do pulmão de grandes células humanas), é frequentemente utilizada para avaliar a citotoxicidade dos compostos de ensaio.
Após o câncer de mama, pulmão e próstata, o câncer de cólon é o quarto câncer mais prevalente em todo o mundo. É o câncer encontrado em frequência aproximadamente igual em homens e mulheres. É a segunda causa mais comum de mortes relacionadas ao câncer nos países ocidentais (Levin et al., 2008; Andre et al., 2009; Ahearn et al., 2012). A linha de células cancerígenas HCT116, obtida a partir de células cancerígenas do cólon humano, é frequentemente utilizada para avaliar a citotoxicidade dos compostos de ensaio.na continuação dos nossos estudos sobre a transformação fúngica de esteróides bioactivos (Choudhary et al.,2005b, c, 2007, 2010; Ahmad et al., 2014; Siddiqui et al., 2017), sintetizamos análogos do enantato de drostanolona (1) através de sua transformação com Cefalosporium aphidicola, e Fusarium lini. Metabólitos 2-9, assim como substrato 1, foram avaliados contra HeLa (carcinoma cervical), PC-3 (carcinoma de próstata), H460 (câncer de pulmão), HCT116 (câncer de cólon), e 3T3 (mouse de fibroblastos normais) linhas de células, o uso de alta taxa de transferência de células do ensaio, o mais eficiente e conveniente método de laboratório, o ensaio de MTT para predizer a resposta do teste de compostos em neoplasias onde eles mostraram a especificidade contra as células do câncer. Este estudo identificou, assim, metabolitos anticancerígenos do enantato de drostanolona (1) para estudos posteriores.
materiais e métodos
análise Instrumental
cromatografia em camada fina (TLC) (sílica-gel, 20 × 20, 0.25 mm de espessura, PF254, Merck, Alemanha) foi utilizada para a análise do grau de transformação e pureza. A cromatografia em coluna de sílica-gel (70-230 mesh, E. Merck, Alemanha) foi utilizada para a purificação inicial de metabolitos. Além disso, a reciclagem da fase reversa preparativa (JAI LC-908W, Japão), equipada com YMC L-80 (4-5 µm, 20-50 mm I. D.), foi utilizada para a purificação final dos metabolitos. As estruturas de metabolitos foram elucidadas com a ajuda de espectrómetros 1H- (400, 500 E 600 MHz) e 13C-NMR (100, 125 E 150 MHz), que foram gravados em espectrómetros Bruker Avance-NMR (França) em CD3OD, CD3COCD3 ou DMSO-d6. Hrei-MS e ir spectra foram realizados em JEOL JMS-600H (Japão) (analisador de massa de setor magnético de dupla focagem) espectrômetro de massa (EI, ionização de impacto eletrônico), e Bruker Vector 22 FT-IR espectrofotômetro, respectivamente. Foram registadas rotações ópticas de metabolitos no Polarímetro JASCO P-2000 (Japão). Evolução 300 espectrofotômetro visível UV foi usado para gravar o espectro UV. Os pontos de fusão dos produtos transformados foram medidos utilizando o instrumento Buchi M-560 (Suíça). Os dados de difração de raios-X de um único cristal foram coletados no difractómetro Bruker APEXII D8 Venture, equipado com detector de fotões 100 (tecnologia CMOS) e tubo selado de foco fino com fonte de raios-X (radiação Cu Ka α = 1,54178 Å). As intensidades de reflexão foram integradas utilizando o software SAINT. A correção da absorção foi feita em varredura múltipla, e a estrutura foi resolvida pelo programa SHELXTL (Gerlier e Thomasset, 1986).; Sheldrick, 2008; Spek, 2009).culturas microbianas de C. aphidicola ATCC 28300 e F. lini nrrl 2204 foram obtidas da American Type Culture Collection (ATCC) e do Northern Regional Research Laboratories (NRRL), respectivamente. As culturas foram cultivadas em Sabouraud dextrose agar (SDA) inclinação, e mantido a 4°C.
Preparação de Media
Quatro litros de mídia para o crescimento de C. aphidicola ATCC-28300 foi preparado misturando 200 g de glicose, 4 g de KH2PO4, 8 g de glicina, 4 g de KCl, 8 g de MgSO4.7H2O, e 8 mL de elementos-traço em 4 L de água destilada. Do mesmo modo, foram preparados quatro litros de meios para F. lini NRRL 2204 misturando 40 g de glucose, 20 g de extracto de levedura, 20 g de peptona, 20 g de KH2PO4, 20 g de NaCl e 40 mL de glicerol em 4 L de água destilada.
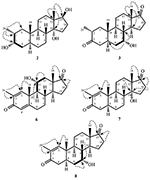
Fermentação de propionato Drostanolone (1) com C. aphidicola ATCC 28300, e F. lini NRRL 2204
Meio para o crescimento de C. aphidicola e F. lini foi preparado pela mistura acima mencionados ingredientes em 4 L de água destilada para cada fungo, que foi dispensado igualmente em 40 frascos de Erlenmeyer de 250 mL (100 mL em cada frasco). Todos estes frascos foram autoclavados a 121°C, e foram inoculados com SDA inclinações de C. aphidicola ATCC 28300 e F. lini NRRL 2204 sob esterilizados condições. Estas culturas fúngicas contendo frascos foram deixadas no agitador rotativo (121 rpm) a 26 ± 2°C durante 3-4 dias para obter o crescimento máximo de C. aphidicola e F. lini. Dissolveu-se o composto 1 (1 g) em 20 mL de acetona para cada fungo, distribuiu-se 0, 5 mL em cada frasco e colocou-se novamente num agitador rotativo durante 12 dias. Um controlo negativo (cultura média + fúngica), bem como um controlo positivo (meio + substrato) também foram preparados analogamente para avaliar os metabolitos fúngicos e a degradação do composto 1, respectivamente. Após incubação de 12 dias, todos os frascos foram filtrados e extraídos com 20 L de diclorometano (DCM), a fase orgânica foi separada, e então evaporada sob pressão reduzida em evaporador rotativo. Isto rendeu 1,5 g de crude amarelo pálido sólido. Este material bruto foi fraccionado por cromatografia em coluna de sílica-gel por eluição com hexanos gradientes e sistemas de solvente de acetona. A cromatografia em coluna revelou quatro fracções principais (1-4), que foram depois purificadas por reciclagem de HPLC. Metabólitos 2 (tR = 16 min, 8 mg, de 0,8%), 3 (tR = 19 min, 11 mg, 1.1%), 4 (tR = 17 min, 35 mg, de 3,5%), 5 (tR = 23 min, 42 mg, 4.2%), 6 (tR = 20 min, 9 mg, de 0,9%), 7 (tR = 21 min, 12 mg, de 1,2%), e 9 (tR = 18 min, 5 mg, de 0,5%) foram purificados a partir de frações de 1 a 7, respectivamente, através de fase reversa, reciclagem HPLC utilizando metanol – água como solvente (sistema de MeOH: H2O; 70: 30). Considerando que o metabolito 8 foi obtido da fracção 8 até à reciclagem em fase normal de HPLC (tR = 32 min, CHCl3: MeOH; 95: 5, 7.5 mg, 0, 75%).
2α-Metil-3α,14α,17ß-trihydroxy-5α-androstano (2)
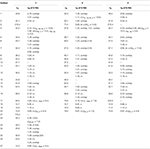
a Tabela 1. Dados de mudança química de 13C – e 1H-NMR (J E W1/2 em Hz) de compostos 1-3 (δ ppm).
2α-Metil-7α-hidroxi-5α-androstan-3,17-diona (3)
2α-Metil-3α,17ß-di-hidroxi-5α-androstano (4)
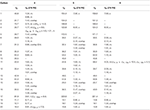
Tabela 2. Dados de mudança química de 13C – e 1H-NMR (J E W1/2 em Hz) de compostos 4-6 (δ ppm).
2-Metilandrosta-1,4-dieno-3,17-diona (5)
2-Metilandrosta-11 hyd-hidroxi-1,4-dieno-3,17-diona (6)
2-Metilandrosta-14 hyd-hidroxi-1,4-diene-3,17-dione (7)
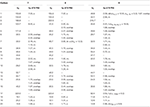
tabela 3. 13C-and 1h-NMR chemical shift data (J e W1 / 2 em Hz) dos compostos 7-9 (ppm ppm).
2-Methylandrosta-7α-hydroxy-1-ene-3,17-dione (8)
2α -Methyl-5α-androstane-17β-hydroxy-3-one (9)
Experimental Protocol for Cytotoxicity
The cytotoxicity of samples was measured against HeLa (human cervical carcinoma ATCC CCl-2), PC-3 (human prostate cancer ATCC CRL-1435), NCl-H460 (human lung carcinoma ATCC HTB-177), HCT116 (human colon cancer ATCC CCl-247), and 3T3 (control fibroblast normal ATCC CRL-1658) cell lines by using standard MTT assay. As linhas celulares foram cultivadas em meio DMEM F12, complementadas com 10% de FBS sob uma atmosfera de 5% de CO2 a 37°C em uma incubadora.o ensaio colorimétrico MTT foi utilizado para a avaliação da actividade metabólica celular. Neste ensaio, o MTT amarelo é reduzido a formazão roxo nas mitocôndrias das células vivas (Gerlier e Thomasset, 1986). Quanto mais as células vivas, mais a cor e, portanto, mais absorvência é observada por colorímetro (Fesahat et al., 2015). Utilizamos este método para analisar o efeito dos nossos produtos transformados na citotoxicidade celular contra as células cancerígenas. Cerca de 10 000 células de cada linha celular (hela, PC3, H460, HCT116 cancros, e 3T3 normal) foram semeadas em placas com 96 alvéolos. Após atingir 80-90% de confluência, foram tratados com várias concentrações de compostos (25, 50, 75, 100 e 200 µM) durante 24 h. todos os compostos foram dissolvidos em DMSO estéril para fazer uma solução-mãe de 200 mM. A solução foi filtrada, e diluições em série foram feitas em meio de crescimento. Foram utilizados 600 µL de cada diluição para tratar 3 alvéolos (triplicado de cada) de 96 alvéolos, ou seja, 200 µL cada. Cada experiência foi realizada em três replicados biológicos. Após a remoção do MTT, os cristais de formazão roxo foram dissolvidos em DMSO, e a leitura foi observada a 540 nm e 570 nm para as células normais e cancerosas, respectivamente. O leitor Multiskano dá λmax a 540 nm em células fibroblastas 3T3 tratadas com DMSO (que são mais confluentes em morfologia) enquanto que no caso de células cancerosas, 570 nm dá λmax (Bonmati-Carrion et al., 2013; Danihelová et al., 2013). Uma ampla gama de linhas celulares de carcinoma epitelial foram usadas neste experimento onde cisplatina era uma droga de escolha comum. Tem como alvo o ADN, interfere com a divisão celular durante a mitose e induz a apoptose (Eastman, 1999). Os valores de CI50 foram calculados para determinar a concentração mínima necessária para matar 50% das células.
Considerando que,
A = Absorvância valor de teste composto
Ab = Absorvância valor em branco
Ca = valor de Absorvância do controlo
Resultados e Discussão
Estrutura de Elucidação
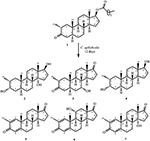
a Figura 1. Biotransformação do enantato de drostanolona (1) com Cefalosporium aphidicola.
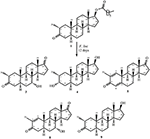
Figura 2. Biotransformação do enantato de drostanolona (1) com Fusarium lini.
metabolito 2 foi isolado como cristais brancos. A fórmula molecular C20H30O3 foi baseada em HREI-MS que mostrou o at M/z 322.2517 (calcd. 322.2508, C20H34O3), sugerindo a adição de três hidrogênio, e um átomo de oxigênio, redução do carbonil C-3 cetônico, e clivagem hidrolítica da cadeia lateral heptanoato no substrato 1. A absorvância de IR a 3,531, e 3,423 cm – 1 foram devido à presença de grupos hidroxila. O espectro 1H-NMR mostrou um sinal adicional de protão metina a δ 3.69 (Quadro 1) (folha de dados 2). Os sinais para a cadeia lateral do heptanoato também foram encontrados em falta no espectro 1H-NMR do composto 2. O espectro 13C-NMR mostrou sinais para um novo carbono metino a δ 71.4, e um novo carbono quaternário a δ 84.8. Sinais de carbono para a cadeia heptanoato e carbonila cetônica também foram encontrados em falta no espectro 13C-NMR. This suggested reduction of C-3 carbonyl, hydrolytic loss of heptanoate chain, and addition of an OH at C-14 (Table 1). O grupo OH foi colocado em C-3 com base em correlações HMBC de H3-20 (δ 0,91, d) com C-3 (δ 71.4) (Figura 3). Isto resultou da redução de C-3 carbonil. O segundo grupo OH foi colocado em C-14, baseado na correlação HMBC de H3-18 (δ 0,81, s) com C-14 (δ 84.8). A terceira OH foi em C-17, resultado da perda hidrolítica da fracção heptanoato. The O-H group at C-3 was deduced to be α-oriented based on the NOESY correlations of H-3 (δ 3,69, br. s) Com β-oriented H-2 (δ 1.64, sobreposição), e α-oriented H3-20 (δ 0.91, d) (Figura 4). O OH-14 foi deduzido para ser orientado a α, baseado em correlações de NOESIA de H-9 (δ 1.32, m) com OH-14 (δ 2.66, s) (acetona-d6). A análise de difração de raios-X de um único cristal apoiou ainda mais a estrutura do metabolito 2, composto por três anéis em conformação de cadeiras (A, B E C), e um em conformação de envelopes (D). Três grupos OH em C-3, C-14 e C-17 foram designados, α -, α -, e β-orientação (Figura 5). Os dados de difração de um único cristal do metabolito 2 foram apresentados à Cambridge Crystallographic Data Collection (CCDC 1500706). A estrutura do metabolito 2 foi assim deduzida como 2α-metil-3α,14α,17β-trihidroxi-5α-androstano.
a Figura 3. Key HMBC ( ), and COSY (
), and COSY ( ) correlations in new metabolites.
) correlations in new metabolites.
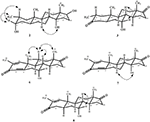
Figura 4. Correlações chave de NOESY em novos metabolitos.
Metabolito 3, foi obtido como um sólido branco. O HREI-MS exibiu o at M / z 318.2192 (calcd. 318.2195, C20H30O3). Isto representou a perda da cadeia lateral de heptanoato, e a adição de um átomo de oxigênio no substrato 1. O espectro de IR mostrou absorvências para OH (3,436 cm−1) e carbonilos cetónicos (1,711 cm−1). No espectro 1H-NMR, sinais da cadeia de heptanoato e protão C-17 metina foram encontrados em falta, enquanto um novo sinal de próton de metina downfield foi observado em δ 3,92 (Tabela 1) (Data sheet 3). Isto sugere hidroxilação do esqueleto esteróide e clivagem oxidativa do grupo heptanoato. O espectro de 13C-NMR também suportou as inferências acima. Sinais de carbono para a fracção heptanoato foram encontrados em falta, enquanto um novo carbonil cetónico e um sinal oxi-metina apareceram no espectro 13C-NMR (Tabela 1). Isto indicou clivagem oxidativa da cadeia de heptanoato e hidroxilação no substrato 1. O protão metino recentemente aparecido em δ 3,92 (H-7) mostrou correlações HMBC com C-5, e C-8, sugerindo uma OH Em C-7 (Figura 3). As correlações HMBC de H3-18 e H2-16 com um Carbono Em δ 223.8 sugerem um carbono cetônico em C-17. OH at C-7 was further supported by COSY correlations of H-7 with H2-6 and H-8. H-7 (δ 3.92, s) mostrou correlações de NOESIA com H-8 Axialmente orientado (δ 1.70, sobreposição), o que sugeriu uma orientação α De OH Em C-7 (Figura 4). Assim, a estrutura do metabolito 3 foi deduzida como 2α-metil-7α-hidroxi-5α-androstano-3,17-diona.também foram realizadas análises de difração de raios-X de cristal único em compostos 1 e 5. O composto 1 era composto por quatro anéis, ou seja, a, B, C E D com conformações de cadeiras, cadeiras, Cadeiras e envelopes. Um metil estava presente em C-2 com orientação equatorial. A cadeia éster de heptanoato estava presente em C-17 do anel D (Figura 6). Considerando que o metabolito 5 contém Anéis A, B, C E D em conformações planas, poltronas, poltronas e envelopes. A cadeia lateral do heptanoato esteve ausente no metabolito 5 (Figura 7). Os dados de difração de um único cristal dos metabolitos 1 e 5 foram submetidos à recolha de dados cristalográficos de Cambridge (CCDC 1500705 e CCDC 1500707, respectivamente). Os dados da análise de difração de raios-X de um único cristal dos compostos 1, 2 e 5 são apresentados na Tabela 4.
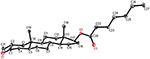
Figura 6. Desenho ORTEP gerado por computador do modelo final de Raio-X do composto 1. Códigos de cor: carbono, preto; oxigénio, vermelho.
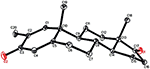
a Figura 7. Desenho ORTEP gerado por computador do modelo final de Raio-X do composto 5. Códigos de cor: carbono, preto; oxigénio, vermelho.

a Tabela 4. Análise de difração de raios-X de um único cristal de compostos 1, 2 e 5.
citotoxicidade contra o cancro HeLa, PC3, H640 e HCT116, e linhagens celulares normais
produtos naturais, por exemplo, flavonóides, esteróides, terpenos, etc. pode servir como uma excelente fonte para a produção de muitas drogas, como eles são relatados para muitas atividades biológicas, tais como anti-câncer, anti-inflamatório, anti-leishmanial, anti-bacteriana, atividades, etc. Portanto, é necessário derivá-los, para estudar a relação estrutura-atividade que pode ser útil para a síntese de drogas seguras e eficazes. Atualmente, muitos produtos farmacêuticos são sintetizados eficientemente através de biotransformação microbiana devido à presença de uma gama de enzimas neles presentes. Com base na actividade anti-cancerígena notificada da drostanolona (9), do propionato de drostanolona e do heptanoato de drostanolona (1), Os compostos 1-9 foram avaliados quanto à citotoxicidade contra as linhagens de células cancerígenas HeLa, PC-3, H460 e HCT116. Curiosamente, todos os compostos mostraram uma atividade anti-câncer moderada a potente. A atividade anti-câncer de compostos 1-9 foi inferida a partir dos valores de CI50 contra HeLa (carcinoma do colo do útero humano), PC-3 (câncer da próstata humana), H460 (câncer do pulmão humano) e HCT116 (câncer do cólon humano) (Tabela 5). Com base nestes resultados, a citotoxicidade destes compostos foi avaliada também contra 3T3 (mouse fibroblastos) normal de linha celular, onde todos os compostos, exceto 8 (IC50 = 74.6 ± 3.7 µM), e 9 (IC50 = 62.1 ± 1.2 µM), foram encontrados para ser não-citotóxicos.

a Tabela 5. Citotoxicidade dos compostos 1-9 contra o cancro HeLa, PC3, H460 e HCT116 e linhagens celulares normais 3T3.
relação estrutura-actividade
variações nas estruturas dos metabolitos efectuaram a sua actividade anti-cancro. O metabolito 2, com a ausência da fracção éster, e dois grupos aO-H no C-3 e C-14, e um grupo ßO-H no C-17, mostraram uma citotoxicidade mais baixa contra as linhas celulares HeLa, H460 e HCT116, mas a sua actividade anti-cancro foi mais elevada contra a linha celular de cancro PC-3, em comparação com o composto 1. O metabolito 3, com a perda do grupo éster e de dois grupos ceto nas linhas C-3 e C-17 e no grupo aO-H nas linhas C-7, também mostrou uma actividade menor contra HeLa, H460 e HCT116, mas aumentou a actividade contra a linha celular cancerígena PC-3 em comparação com o substrato 1. A redução do C-3 carbonil para o-H e a clivagem hidrolítica da fracção éster no composto 4 aumentaram a sua actividade contra as linhas celulares Hela e PC-3 cancerosas, em certa medida, mas a sua actividade anti-cancro contra o H460 e as linhas celulares de cancro HCT116 diminuíram em comparação com o substrato 1. A presença de C = C entre C-1/C-2 e C-4/C-5, juntamente com C = O A C-3, e C-17 tornaram o metabolito 5 um potente agente anti-cancerígeno contra a linha celular de cancro HeLa, em comparação com o substrato 1 e o fármaco padrão (cisplatina). Além disso, a sua actividade anti-cancro contra a linha de células cancerígenas PC-3 Foi também aumentada em comparação com o substrato 1. Curiosamente, sua atividade anti-câncer contra H460, e linhas celulares de câncer HCT116 foi menor em comparação com o composto 1. A presença de C = C entre C-1/C-2 e C-4/C-5, C = O A C-3 e C-17, juntamente com o grupo aO-H A C-11 no metabolito 6, aumentou a sua actividade anti-cancro contra o HeLa, e as linhas das células cancerígenas PC-3 em comparação com o substrato 1 e mostrou um potencial anti-cancro semelhante contra a linha das células cancerígenas HeLa como medicamento padrão (cisplatina). No entanto, sua atividade anti-câncer contra H460, e linhas celulares de câncer HCT116 diminuíram em comparação com o composto 1. A presença de C = C entre C-1/C-2 e C-4/C-5, C = O A C-3 e C-17, juntamente com o grupo aO-H A C-14 no metabolito 7, aumentou novamente a sua actividade anti-cancro contra HeLa, e as linhas celulares de cancro PC-3, e diminuiu a sua actividade anti-cancro contra H460, e as linhas celulares HCT116 em comparação com o substrato 1. A presença de C = C Em C-1/C-2, C = o em C-3, E C-17, e aOH em C-7 tornaram o metabolito 8 o mais potente anti-cancro contra a linha celular de cancro HeLa em comparação com o substrato 1 e o fármaco padrão (cisplatina). Também mostrou uma boa atividade contra a linha celular de câncer PC-3, mas diminuiu a atividade anti-câncer contra H460, e linhas celulares de câncer HCT116 em comparação com o substrato 1. O metabolito 9, com apenas hidrólise no C-17, demonstrou um aumento da actividade anti-cancro contra as linhas celulares hela, PC-3 e HCT116, mas diminuiu a citotoxicidade contra a linha das células cancerígenas H460 em comparação com o substrato 1 e o fármaco-padrão (cisplatina). Com base na discussão acima, pode concluir-se que o aumento da atividade anti-câncer dos compostos 5-8 contra HeLa, e as linhas celulares de câncer PC-3 foi provavelmente devido à presença de C = C Em C-1/C-2, e carbonil cetona em C-3, E C-17 em comparação com o substrato 1.
Conclusion
Author Contributions
The concept of presented research was developed and designed by MIC. O MIC também era o supervisor do projeto. Todos os dados foram analisados e interpretados por MIC, A-t-W e HC. MS, SY, MA e NF realizaram as experiências. MIC, A-T-W, E MS escreveram o manuscrito. Todos os autores revisaram o manuscrito. A versão final do manuscrito também foi aprovada pelo MIC antes da submissão.
Declaração de conflito de interesses
os autores declaram que a investigação foi realizada na ausência de quaisquer relações comerciais ou financeiras que possam ser interpretadas como um potencial conflito de interesses.
Agradecimentos
-W, e MIC reconhece o papel que o Ensino Superior Comissão, Islamabad, Paquistão, através de um apoio financeiro no âmbito, “Estudos sobre o Chemoprevention de Carcinogênese Mamária por Dietético Agentes, (20-3790/NRPU/R&D/HEC/13/793).”Sy reconhece o apoio financeiro da OPAQ (organização para a proibição de Armas Químicas) através de um projeto de pesquisa intitulado “estudos estruturais e biológicos sobre novos esteróides anabolizantes obtidos por biotransformação.”HC reconhece o apoio financeiro de” The Deanship of Scientific Research (DSR), King Abdulaziz University, Ministry of Education, Saudi Arabia.”
material suplementar
Eastman, A. (1999). “O mecanismo de acção da Cisplatina: dos adutos à apoptose”, na Cisplatina: Chemistry and Biochemistry of a Leading Anticancer Drug, ed B. Lippert (Zürich: Verlag Helvetica Chimica Acta), 111-134. doi: 10.1002/9783906390420.ch4
CrossRef Texto Completo | Google Scholar
Vardar, E., Vardar, S. A., e Cengiz, T. (2002). Abuso de esteróides anabolizantes androgénicos. Chato. J. Psychiatry 3, 104-107.